APOE-4: مفتاح لماذا النظام الغذائي قليل الدسم والستاتين
قد يسبب الزهايمر
نبذة مختصرة
مرض الزهايمر مرض مدمر يتزايد معدل حدوثه بشكل واضح في أمريكا. لحسن الحظ ، يتم إنفاق عدد كبير من دولارات البحث حاليًا لمحاولة فهم أسباب مرض الزهايمر. ApoE-4 ، أليل معين من apolipoprotein apoE ، هو عامل خطر معروف. نظرًا لأن apoE يلعب دورًا حاسمًا في نقل الكوليسترول والدهون إلى الدماغ ، يمكن الافتراض أن نقص الدهون والكوليسترول في الدماغ يلعبان دورًا حاسمًا في عملية المرض. في دراسة حديثة ملحوظة ، وجد أن مرضى الزهايمر لديهم 1/6 فقط من تركيز الأحماض الدهنية الحرة في السائل الدماغي الشوكي مقارنة بالأشخاص الذين ليس لديهم مرض الزهايمر. في موازاة ذلك ، أصبح من الواضح جدًا أن الكوليسترول منتشر في الدماغ ، وأنه يلعب دورًا حاسمًا في النقل العصبي في المشبك وفي الحفاظ على صحة الألياف العصبية لطلاء غمد المايلين. تم العثور على نظام غذائي عالي الدهون (الكيتون) لتحسين القدرة الإدراكية لدى مرضى الزهايمر. هذه الملاحظات والملاحظات الأخرى الموضحة أدناه تقودني إلى الاستنتاج أن كلاً من النظام الغذائي قليل الدسم والعلاج بعقاقير الستاتين يزيد من قابلية الإصابة بمرض الزهايمر ،
1 المقدمة
مرض الزهايمر هو مرض مدمر يسلب العقل شيئًا فشيئًا على مدى عقود. تبدأ فجوات الذاكرة الغريبة ولكن بعد ذلك تقوض حياتك بثبات إلى النقطة التي تكون فيها الرعاية على مدار الساعة هي الخيار الوحيد. مع مرض الزهايمر الشديد ، يمكنك بسهولة التجول وتضيع ، وقد لا تتعرف على ابنتك. كان مرض الزهايمر مرضًا معروفًا قليلاً قبل عام 1960 ، ولكنه اليوم يهدد بتعطيل النظام الصحي تمامًا في الولايات المتحدة.
يوجد حاليًا أكثر من 5 ملايين شخص في أمريكا مصابون بمرض الزهايمر. في المتوسط ، يكلف الشخص الذي يزيد عمره عن 65 عامًا المصاب بمرض الزهايمر ثلاثة أضعاف تكاليف الرعاية الصحية مثل الشخص الذي لا يعاني من مرض الزهايمر. الأمر الأكثر إثارة للقلق هو أن معدل الإصابة بمرض الزهايمر آخذ في الارتفاع. درس الدكتور موراي والدمان البيانات الوبائية التي تقارن مرض الزهايمر مع كسور عظم الفخذ ، بالنظر إلى الوراء على مدى السنوات الخمسين الماضية [52]. من المثير للقلق أنه وجد أنه في حين أن معدل حدوث كسور عظم الفخذ (حالة أخرى تزداد عادة مع تقدم العمر) لم يرتفع إلا بمعدل خطي ، فإن الزيادة في الإصابة بمرض الزهايمر ارتفعت بشكل كبير ، بين عامي 1960 و 2010 وباء الزهايمر [ 15]. بين عامي 2000 و 2006 ، ارتفعت وفيات مرض الزهايمر في الولايات المتحدة بنسبة 47٪ ، بينما انخفضت الوفيات الناجمة عن أمراض القلب وسرطان الثدي وسرطان البروستاتا والسكتة الدماغية مجتمعة بنسبة 11٪. هذه الزيادة تتجاوز بكثير الأشخاص الذين يعيشون لفترة أطول: بالنسبة للأشخاص الذين يبلغون من العمر 85 عامًا وأكثر ، ارتفعت النسبة المئوية للوفاة بسبب مرض الزهايمر بنسبة 30٪ بين عامي 2000 و 2005 [2]. أخيرًا ، من المحتمل أن يكون هذا أقل من التقديرات ، لأن العديد من الأشخاص الذين يعانون من مرض الزهايمر يموتون في النهاية بسبب شيء آخر. من المحتمل أن يكون لديك صديق مقرب أو قريب يعاني من مرض الزهايمر.
هناك شيء في أسلوب حياتنا الحالي يزيد من احتمالية خضوعنا لمرض الزهايمر. اعتقادي هو أن اثنين من المساهمين الرئيسيين هم هوسنا الحالي بنظام غذائي قليل الدسم ، إلى جانب الاستخدام المتزايد باستمرار لعقاقير الستاتين. لقد جادلت في مكان آخر أن النظام الغذائي قليل الدسم قد يكون عاملاً رئيسيًا في الزيادة المقلقة في التوحد و adhd لدى الأطفال. لقد جادلت أيضًا بأن وباء السمنة ومتلازمة التمثيل الغذائي المرتبطة بها يمكن إرجاعها إلى نظام غذائي منخفض الدهون المفرط. من المحتمل أن تسهم العقاقير المخفضة للكوليسترول في زيادة العديد من المشكلات الصحية الخطيرة إلى جانب مرض الزهايمر ، مثل الإنتان ، وفشل القلب ، وتلف الجنين ، والسرطان ، كما ذكرت هنا. أعتقد أن الاتجاهات ستزداد سوءًا في المستقبل ، إلا إذا قمنا بتغيير وجهة نظرنا الحالية حول "الحياة الصحية".
الأفكار التي تم تطويرها في هذا المقال هي نتيجة لأبحاث واسعة النطاق أجريت عبر الإنترنت لمحاولة فهم العملية التي يتطور بها مرض الزهايمر. لحسن الحظ ، يتم إنفاق قدر كبير من أموال البحث حاليًا على مرض الزهايمر ، ولكن لا يزال هناك سبب واضح المعالم بعيد المنال. ومع ذلك ، هناك العديد من الخيوط المثيرة الجديدة خارج الصحافة ، وبدأت قطع الألغاز في تجميع نفسها في قصة متماسكة. يكتشف الباحثون مؤخرًا فقط أن كل من الدهون والكوليسترول يعانون من نقص حاد في دماغ الزهايمر. اتضح أن الدهون والكوليسترول كلاهما مغذيات حيوية في الدماغ. يحتوي الدماغ على 2٪ فقط من كتلة الجسم ، و 25٪ من إجمالي الكوليسترول. الكولسترول ضروري لنقل الإشارات العصبية ومكافحة العدوى.
الجزء الحاسم من اللغز هو علامة وراثية تؤهل الناس لمرض الزهايمر ، وتسمى "apoE-4". يلعب ApoE دورًا مركزيًا في نقل الدهون والكوليسترول. يوجد حاليًا خمسة أنواع مختلفة مميزة من apoE (يطلق عليها بشكل صحيح "الأليلات") ، مع الأنواع التي تحمل علامة "2" و "3" و "4" الأكثر انتشارًا. ثبت أن ApoE-2 يوفر بعض الحماية ضد مرض الزهايمر. apoE-3 هو الأليل "الافتراضي" الأكثر شيوعًا ، و apoE-4 ، الموجود في 13-15٪ من السكان ، هو الأليل المرتبط بزيادة خطر الإصابة بمرض الزهايمر. الشخص المصاب بأليل apoE-4 الموروث من كل من والدته ووالده يزيد من احتمالية الإصابة بمرض الزهايمر بمقدار عشرين مرة. كان فهم أدوار apoE العديدة في الجسم خطوة رئيسية تؤدي إلى نظريتي المقترحة قليلة الدهون / الستاتين.
2. الخلفية: بيولوجيا الدماغ 101
على الرغم من أنني حاولت كتابة هذا المقال بطريقة يمكن الوصول إليها من قبل غير الخبراء ، إلا أنه سيكون من المفيد أولاً تعريفك بالمعرفة الأساسية ببنية الدماغ والأدوار التي تلعبها أنواع الخلايا المختلفة داخل الدماغ.
في أبسط مستوى ، يمكن وصف الدماغ بأنه يتكون من مكونين رئيسيين: المادة الرمادية والمادة البيضاء. تتكون المادة الرمادية من أجسام الخلايا العصبية ، بما في ذلك نواة الخلية ، وتحتوي المادة البيضاء على عدد لا يحصى من "الأسلاك" التي تربط كل خلية عصبية بكل خلية عصبية أخرى تتواصل معها. تُعرف الأسلاك باسم "المحاور" ويمكن أن تكون طويلة جدًا ، حيث تربط ، على سبيل المثال ، الخلايا العصبية الموجودة في القشرة الأمامية (فوق العينين) بخلايا عصبية أخرى عميقة داخل الدماغ تتعلق بالذاكرة والحركة. سوف تظهر المحاور بشكل بارز في المناقشات أدناه ، لأنها مطلية بمادة دهنية تسمى غمد المايلين ، ومن المعروف أن هذه الطبقة العازلة معيبة في مرض الزهايمر. تلتقط الخلايا العصبية الإشارات المرسلة عبر المحاوير عند التقاطعات المعروفة باسم نقاط الاشتباك العصبي. هنا تحتاج الرسالة إلى أن تنتقل من خلية عصبية إلى أخرى ، كما أن الناقلات العصبية المختلفة مثل الدوبامين و GABA تمارس تأثيرات مثيرة أو مثبطة على قوة الإشارة. في إضافة إلى محوار واحد ، عادةً ما تحتوي الخلايا العصبية على العديد من الألياف العصبية أقصر بكثير تسمى التشعبات ، والتي تتمثل وظيفتها في استقبال الإشارات الواردة من مصادر متنوعة. في نقطة معينة من الزمن ، يتم دمج الإشارات المستلمة من مصادر متعددة في جسم الخلية ويتم اتخاذ قرار بشأن ما إذا كانت قوة الإشارة المتراكمة أعلى من العتبة ، وفي هذه الحالة يستجيب العصبون بإطلاق سلسلة من النبضات الكهربائية ، والتي هي ثم تنتقل عبر المحور العصبي إلى وجهة بعيدة ربما.
بالإضافة إلى الخلايا العصبية ، يحتوي الدماغ أيضًا على عدد كبير من الخلايا "المساعدة" التي تسمى الخلايا الدبقية ، والتي تهتم برعاية الخلايا العصبية وتغذيتها. تلعب ثلاثة أنواع رئيسية من الخلايا الدبقية دورًا في مناقشتنا التالية: الخلايا الدبقية الصغيرة ، الخلايا النجمية ، والخلايا الدبقية قليلة التغصن. الخلايا الدبقية الصغيرة هي ما يعادل خلايا الدم البيضاء في بقية الجسم. هم مهتمون بمكافحة العوامل المعدية مثل البكتيريا والفيروسات ، كما أنهم يراقبون صحة الخلايا العصبية ، ويتخذون قرارات الحياة والموت: برمجة خلية عصبية معينة من أجل الاستماتة (التدمير الذاتي المتعمد) إذا بدا أنه لا يعمل بشكل جيد. الانتعاش ، أو مصاب بكائن خطير للغاية بحيث لا يسمح له بالازدهار.
تظهر الخلايا النجمية بشكل بارز جدًا في قصتنا أدناه. إنها تقاوم الخلايا العصبية وهي مسؤولة عن ضمان الإمداد الكافي من العناصر الغذائية. أظهرت الدراسات التي أجريت على الثقافات العصبية من الأجهزة العصبية المركزية القوارض أن الخلايا العصبية تعتمد على الخلايا النجمية لتزويدها بالكوليسترول [40]. تحتاج الخلايا العصبية بشدة إلى الكوليسترول ، في المشبك [50] وفي غمد المايلين [45] ، من أجل نقل إشاراتها بنجاح ، وكذلك كخط دفاع أول ضد الميكروبات الغازية. يعتبر الكوليسترول مهمًا جدًا للدماغ لدرجة أن الخلايا النجمية قادرة على توليده من المكونات الأساسية ، وهي مهارة لا توجد في معظم أنواع الخلايا. كما أنها تزود الخلايا العصبية بالأحماض الدهنية ، وهي قادرة على تناول الأحماض الدهنية قصيرة السلسلة ودمجها لتشكيل أنواع أطول من الأحماض الدهنية البارزة بشكل خاص في الدماغ [7] [24] [36] ، ثم إيصالها إلى الخلايا العصبية المجاورة وإلى السائل الدماغي الشوكي.
النوع الثالث من الخلايا الدبقية هو الخلايا الدبقية قليلة التغصن. تتخصص هذه الخلايا في التأكد من أن غمد المايلين سليم. تقوم خلايا Oligodentrocytes بتجميع حمض دهني خاص يحتوي على الكبريت ، يعرف باسم كبريتيد ، من الأحماض الدهنية الأخرى التي يزودها بها السائل النخاعي [9]. ثبت أن الكبريتات ضروري للحفاظ على غمد المايلين. يعاني الأطفال الذين يولدون بعيب في القدرة على استقلاب الكبريتات من إزالة الميالين التدريجي ، والفقدان السريع للوظائف الحركية والمعرفية ، مما يؤدي إلى الوفاة المبكرة قبل سن 5 [29]. استنفاد في كبريتيد هو توصيف معروف لمرض الزهايمر ، حتى في المراحل المبكرة قبل أن يتجلى في التدهور المعرفي [18]. وقد ثبت أن ApoE يلعب دورًا حاسمًا في الحفاظ على الكبريتات [19]. طوال حياة الشخص ، يجب الحفاظ على غمد المايلين وإصلاحه باستمرار. هذا شيء بدأ الباحثون في تقديره فقط ، لكن خاصيتين مرتبطتين بمرض الزهايمر هما غمد المايلين رديء الجودة جنبًا إلى جنب مع انخفاض كبير في تركيز الأحماض الدهنية والكوليسترول في السائل النخاعي [38].
3. إدارة الكوليسترول والدهون
بالإضافة إلى بعض المعرفة حول الدماغ ، ستحتاج أيضًا إلى معرفة شيء عن العمليات التي تنقل الدهون والكوليسترول إلى جميع أنسجة الجسم ، مع التركيز بشكل خاص على الدماغ. يمكن لمعظم أنواع الخلايا استخدام الدهون أو الجلوكوز (سكر بسيط مشتق من الكربوهيدرات) كمصدر للوقود لتلبية احتياجاتهم من الطاقة. ومع ذلك ، فإن الدماغ هو الاستثناء الوحيد الضخم لهذه القاعدة. جميع الخلايا في الدماغ ، سواء الخلايا العصبية أو الخلايا الدبقية ، غير قادرة على استخدام الدهون للوقود. هذا على الأرجح لأن الدهون ثمينة جدًا للدماغ. يتطلب غمد المايلين إمدادات مستمرة من الدهون عالية الجودة لعزل وحماية المحاور المغلقة. بما أن الدماغ يحتاج إلى دهونه للبقاء على المدى الطويل ، فمن الأهمية بمكان حمايتها من الأكسدة (من خلال التعرض للأكسجين) ومن هجوم الميكروبات الغازية.
تأتي الدهون بجميع أنواعها وأحجامها. أحد الأبعاد هو درجة التشبع ، والتي تتعلق بعدد الروابط المزدوجة التي تمتلكها ، مع عدم احتواء الدهون المشبعة على شيء ، والدهون الأحادية غير المشبعة التي تحتوي على واحد فقط ، والدهون المتعددة غير المشبعة التي تحتوي على اثنين أو أكثر. يكسر الأكسجين الرابطة المزدوجة ويترك الدهون المؤكسدة ، وهو ما يمثل مشكلة للدماغ. وبالتالي فإن الدهون المتعددة غير المشبعة هي الأكثر عرضة للتعرض للأكسجين ، بسبب الروابط المزدوجة المتعددة.
يتم هضم الدهون في الأمعاء وإطلاقها في مجرى الدم على شكل كرة كبيرة نسبيًا مع طبقة بروتينية واقية تسمى chylomicron. يمكن لل chylomicron توفير الوقود مباشرة للعديد من أنواع الخلايا ، ولكن يمكن أيضًا إرساله إلى الكبد حيث يتم فرز الدهون الموجودة
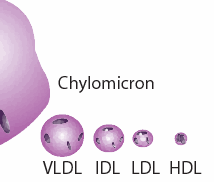 وإعادة توزيعها إلى جزيئات أصغر بكثير ، والتي تحتوي أيضًا على كميات كبيرة من الكوليسترول. تسمى هذه الجسيمات "البروتينات الدهنية" (من الآن فصاعدًا ، LPP's) لأنها تحتوي على بروتين في الغلاف الكروي والدهون (الدهون) في الداخل. إذا قمت بقياس الكوليسترول لديك ، فربما سمعت عن LDL (LPP منخفض الكثافة) و HDL (LPP عالي الكثافة). إذا كنت تعتقد أن هذين نوعين مختلفين من الكوليسترول ، فستكون مخطئًا. وهما نوعان مختلفان من حاويات الكوليسترول والدهون التي تؤدي أدوارًا مختلفة في الجسم. في الواقع هناك العديد من LPP الأخرى ،
وإعادة توزيعها إلى جزيئات أصغر بكثير ، والتي تحتوي أيضًا على كميات كبيرة من الكوليسترول. تسمى هذه الجسيمات "البروتينات الدهنية" (من الآن فصاعدًا ، LPP's) لأنها تحتوي على بروتين في الغلاف الكروي والدهون (الدهون) في الداخل. إذا قمت بقياس الكوليسترول لديك ، فربما سمعت عن LDL (LPP منخفض الكثافة) و HDL (LPP عالي الكثافة). إذا كنت تعتقد أن هذين نوعين مختلفين من الكوليسترول ، فستكون مخطئًا. وهما نوعان مختلفان من حاويات الكوليسترول والدهون التي تؤدي أدوارًا مختلفة في الجسم. في الواقع هناك العديد من LPP الأخرى ،
أو مثال ، VLDL (منخفض جدًا) و IDL (متوسط) ، كما هو موضح في الرسم التخطيطي المصاحب. VLDL ، IDL ، LDL ، HDL في هذا المقال ، سأشير إليها بشكل جماعي باسم XDL. كما لو أن هذا لم يكن مربكًا بما فيه الكفاية ، هناك أيضًا XDL فريد آخر 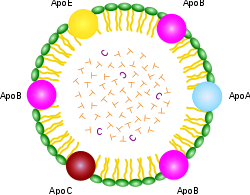 موجود فقط في السائل الدماغي الشوكي ، والذي يوفر الاحتياجات الغذائية للدماغ والجهاز العصبي. لا يبدو أن هذا الاسم يحمل اسمًا بعد ، لكنني سأطلق عليه "B-HDL" ، لأنه يشبه HDL من حيث حجمه ، و "B" هو لـ "الدماغ [13]"
موجود فقط في السائل الدماغي الشوكي ، والذي يوفر الاحتياجات الغذائية للدماغ والجهاز العصبي. لا يبدو أن هذا الاسم يحمل اسمًا بعد ، لكنني سأطلق عليه "B-HDL" ، لأنه يشبه HDL من حيث حجمه ، و "B" هو لـ "الدماغ [13]"
نقطة مهمة حول جميع XDL هي أنها تحتوي على تركيبات مختلفة بشكل واضح ، وكل منها مستهدف (مبرمج) لأنسجة معينة. مجموعة من البروتينات تسمى "بروتينات apolipoproteins" أو "بروتينات apoproteins"
هورت) الرقم بقوة في السيطرة على من Chylomicron Structuregets ما. كما ترون من تخطيطي chylomicron الموضح على اليمين ، فإنه يحتوي على قوس قزح من apo مختلفة لكل تطبيق يمكن تصوره. لكن XDL أكثر تحديدًا بكثير ، حيث تحتوي HDL على "A" و LDL الذي يحتوي على "B" و VLDL الذي يحتوي على "B" و "C" و IDL يحتوي فقط على "E." يحتوي apo على خصائص ربط خاصة تسمح بنقل محتويات الدهون عبر أغشية الخلية حتى تتمكن الخلية من الوصول إلى الدهون والكولسترول المتضمن في الداخل.
apo الوحيد الذي يهمنا في سياق هذا المقال هو apoE. يعد ApoE مهمًا جدًا لقصتنا بسبب ارتباطه المعروف بمرض الزهايمر. ApoE هو بروتين ، أي تسلسل الأحماض الأمينية ، ويتم تحديد تكوينه المحدد بواسطة تسلسل DNA المقابل على جين ترميز البروتين. تؤدي بعض التغييرات في رمز DNA إلى عيوب في قدرة البروتين المنسوخ على أداء أدواره البيولوجية. يفترض أن ApoE-4 ، الأليل المرتبط بزيادة خطر الإصابة بمرض الزهايمر ، غير قادر على أداء مهامه بكفاءة مثل الأليلات الأخرى. من خلال فهم ما يفعله apoE ، يمكننا أن نستنتج بشكل أفضل كيف يمكن أن تؤثر عواقب القيام بذلك بشكل سيئ على الدماغ ، ومن ثم نلاحظ تجريبيًا ما إذا كانت ميزات دماغ الزهايمر تتوافق مع الأدوار التي يلعبها apoE.
يمكن استخلاص دليل قوي حول أدوار apoE من مكانها. كما ذكرت أعلاه ، هو apo الوحيد في كل من B-HDL في السائل النخاعي و IDL في مصل الدم. فقط أنواع الخلايا المختارة يمكنها توليفها ، وأهمها لأغراضنا هي الكبد والخلايا النجمية في الدماغ. وبالتالي توفر الخلايا النجمية الصلة بين الدم والسائل النخاعي. يمكنهم إيصال الدهون والكوليسترول عبر الحاجز الدموي الدماغي عن طريق المفتاح الخاص الذي هو apoE.
اتضح أنه على الرغم من عدم وجود apoE في LDL ، إلا أنه يرتبط بـ LDL ، وهذا يعني أنه يمكن للخلايا النجمية فتح مفتاح LDL بنفس الطريقة التي يمكنها بها الوصول إلى IDL ، وبالتالي محتوى الكوليسترول والأحماض الدهنية من LDL متاحة للخلايا النجمية أيضًا ، طالما أن apoE يعمل بشكل صحيح. تعيد الخلايا النجمية تشكيل وإعادة تعبئة الدهون وإطلاقها في السائل المخي الشوكي ، مثل B-HDL وببساطة كأحماض دهنية مجانية ، متاحة لامتصاص جميع أجزاء الدماغ والجهاز العصبي [13].
تتمثل إحدى خطوات إعادة التشكيل الحاسمة في تحويل الدهون إلى أنواع أكثر جاذبية للدماغ. لفهم هذه العملية ، تحتاج إلى معرفة بعد آخر من الدهون إلى جانب درجة تشبعها ، وهو طولها الإجمالي. تحتوي الدهون على سلسلة من ذرات الكربون المرتبطة كعمودها الفقري ، ويميزها العدد الإجمالي للكربونات في دهون معينة بأنها قصيرة أو متوسطة الطول أو طويلة. يعمل الدماغ بشكل أفضل عندما تكون الدهون المكونة طويلة ، وبالفعل ، فإن الخلايا النجمية قادرة على امتصاص الدهون قصيرة السلسلة وإعادة تنظيمها لإنتاج الدهون الطويلة السلسلة [24].
البعد النهائي للدهون التي تلعب دورًا هو المكان الذي توجد فيه الرابطة المزدوجة الأولى في الدهون المتعددة غير المشبعة ، والتي تميز أوميغا 3 عن دهون أوميغا 6 (الموضع 3 ؛ الموضع 6). دهون أوميجا 3 شائعة جدًا في الدماغ. بعض الأحماض الدهنية أوميغا 3 وأوميغا 6 هي أحماض دهنية أساسية ، حيث أن جسم الإنسان غير قادر على توليفها ، وبالتالي يعتمد على إمداداتها من النظام الغذائي. هذا هو السبب في الادعاء بأن الأسماك "تجعلك ذكيًا": لأن أسماك المياه الباردة هي أفضل مصدر لدهون أوميجا 3 الأساسية.
الآن أريد العودة إلى موضوع XDL. إنها رحلة خطيرة من الكبد إلى الدماغ ، حيث يوجد كل من الأكسجين والميكروبات بكثرة في مجرى الدم. يحتوي غلاف XDL الواقي على كل من الكوليسترول المنخفض الكثافة والكوليسترول غير المعالج ، بالإضافة إلى apo المميز الذي يتحكم في الخلايا التي يمكن أن تتلقى
والمحتويات الداخلية هي الكوليسترول والأحماض الدهنية الأسترة ، إلى جانب بعض مضادات الأكسدة التي يتم نقلها بسهولة إلى الخلايا المعبأة في نفس سفينة الشحن. الأسترة هي تقنية لجعل الدهون والكوليسترول خاملًا ، مما يساعد على حمايتها من الأكسدة [51]. إن وجود مضادات الأكسدة (مثل فيتامين E و Coenzyme Q10) أثناء الرحلة أمر مريح أيضًا ، حيث أنها تحمي أيضًا من الأكسدة. ومع ذلك ، فإن الكوليسترول الموجود في القشرة غير متعمد ، مما يعني أنه نشط. أحد أدوارها هو الحماية من البكتيريا والفيروسات الغازية  [55]. الكولسترول هو خط الدفاع الأول ضد هذه الميكروبات ، حيث أنه ينبه خلايا الدم البيضاء للهجوم كلما واجهت مسببات الأمراض الخطيرة. كما تم اقتراح أن الكوليسترول في غلاف XDL يعمل كمضاد للأكسدة [48].
[55]. الكولسترول هو خط الدفاع الأول ضد هذه الميكروبات ، حيث أنه ينبه خلايا الدم البيضاء للهجوم كلما واجهت مسببات الأمراض الخطيرة. كما تم اقتراح أن الكوليسترول في غلاف XDL يعمل كمضاد للأكسدة [48].
يتم استنفاد HDL في الغالب من محتوى الدهون والكوليسترول ، ويتم تكليفهم بإعادة القشرة الفارغة إلى الكبد. بمجرد الوصول إلى هناك ، سيتم إعادة تشغيل الكوليسترول لدخول الجهاز الهضمي كجزء من الصفراء ، التي تنتجها المرارة للمساعدة على هضم الدهون المبتلعة. لكن الجسم حريص للغاية على الحفاظ على الكوليسترول ، بحيث يتم إعادة تدوير 90 ٪ منه من القناة الهضمية مرة أخرى إلى مجرى الدم ، الموجود في chylomicron الذي بدأ قصتنا عن الدهون.
وباختصار ، فإن إدارة توزيع الدهون والكوليسترول على خلايا الجسم هي عملية معقدة ، منسقة بعناية لضمان أن يكون لديهم رحلة آمنة إلى وجهتهم. المخاطر الكامنة في مجرى الدم ، ومعظمها في شكل الأكسجين والميكروبات الغازية. يعتبر الجسم الكوليسترول حمولة ثمينة ، وهو حريص جدًا على حفظه ، من خلال إعادة تدويره من القناة الهضمية إلى الكبد ، ليتم توزيعه بشكل مناسب بين XDL الذي سينقل الكوليسترول والدهون إلى الأنسجة التي تعتمد عليها. وخاصة الدماغ والجهاز العصبي.
4. العلاقة بين الكوليسترول ومرض الزهايمر
من خلال الدراسات بأثر رجعي ، كانت صناعة الستاتين ناجحة للغاية في لعبة التظاهر بأن الفوائد المستمدة من ارتفاع الكوليسترول هي في الواقع بسبب العقاقير المخفضة للكوليسترول ، كما وصفت بإسهاب في مقال عن العلاقة بين العقاقير المخفضة للكوليسترول وتلف الجنين ، والإنتان ، والسرطان ، وفشل القلب. في حالة مرض الزهايمر ، يلعبون هذه اللعبة في الاتجاه المعاكس: إنهم يلومون الكوليسترول على مشكلة خطيرة جدًا أعتقد أنها ناتجة عن العقاقير المخفضة للكوليسترول.
بدت صناعة الستاتين طويلة وصعبة للحصول على أدلة على أن ارتفاع نسبة الكوليسترول قد يكون عامل خطر لمرض الزهايمر. قاموا بفحص مستويات الكوليسترول للرجال والنساء من جميع الأعمار بين 50 و 100 عامًا ، بالنظر إلى 30 عامًا أو أكثر إذا لزم الأمر ، لمعرفة ما إذا كان هناك أي ارتباط بين ارتفاع الكوليسترول ومرض الزهايمر. وجدوا علاقة واحدة ذات دلالة إحصائية فقط: الرجال الذين لديهم نسبة عالية من الكوليسترول في الخمسينات لديهم قابلية متزايدة للإصابة بمرض الزهايمر في وقت لاحق من الحياة [3].
لقد قفزت صناعة الستاتين على هذه الفرصة لتدل على أن ارتفاع نسبة الكوليسترول قد يسبب مرض الزهايمر ، وفي الواقع ، كانوا محظوظين جدًا لأن الصحافيين أخذوا الطعم وهم يروجون لفكرة أنه إذا ارتبط ارتفاع نسبة الكوليسترول منذ سنوات عديدة بمرض الزهايمر ، ثم قد تحمي الستاتينات من مرض الزهايمر. لحسن الحظ ، توجد صفحات ويب طويلة (الكوليسترول لا يسبب مرض الزهايمر) التي وثقت قائمة طويلة من الأسباب التي تجعل هذه الفكرة سخيفة.
الرجال الذين لديهم نسبة عالية من الكوليسترول في الخمسينات هم الطفل الملصق لعلاج العقاقير المخفضة للكوليسترول: جميع الدراسات التي أظهرت فائدة للستاتين من حيث تقليل عدد الأزمات القلبية البسيطة التي تصيب الرجال في الخمسينات. يرتبط ارتفاع نسبة الكولسترول في الدم بشكل إيجابي مع طول العمر لدى الأشخاص الذين تزيد أعمارهم عن 85 عامًا [54] ، وقد ثبت أنه مرتبط بوظيفة ذاكرة أفضل [53] وانخفاض الخرف [35]. والعكس صحيح أيضًا: الارتباط بين انخفاض مستويات الكوليسترول ومرض الزهايمر [39]. كما سيتم مناقشته لاحقًا ، فإن الأشخاص المصابين بمرض الزهايمر لديهم أيضًا مستويات منخفضة من B-HDL ، وكذلك انخفاضًا حادًا في مستويات الأحماض الدهنية ، في السائل الخزفي الشوكي ، أي إمداد الفقراء من الكوليسترول والدهون إلى غمد المايلين [38]. كما رأينا سابقًا ، فإن توريد الأحماض الدهنية ضروري كعناصر بناء للكبريتيد الذي يتم تصنيعه بواسطة الخلايا الدبقية قليلة التغصن للحفاظ على غمد المايلين صحيًا [29].
الدراسة الواضحة التي يجب القيام بها هي بن الرجال الذين لديهم نسبة عالية من الكوليسترول في خمسينياتهم إلى ثلاث مجموعات: أولئك الذين لم يتناولوا العقاقير المخفضة للكوليسترول أبدًا ، والذين تناولوا جرعات أصغر لفترات أقصر ، وأولئك الذين تناولوا جرعات أكبر لفترات أطول. لن يكون من الصعب إجراء مثل هذه الدراسة ؛ في الواقع ، أظن أنه تم بالفعل تنفيذ شيء من هذا القبيل. لكنك لن تسمع عنها أبدًا لأن صناعة الستاتين دفنت النتائج.
في دراسة جماعية بأثر رجعي طويلة الأمد لأعضاء برنامج الرعاية الطبية الدائمة في شمال كاليفورنيا ، درس الباحثون بيانات الكوليسترول التي تم الحصول عليها بين عامي 1964 و 1973 [46]. قاموا بدراسة ما يقرب من عشرة آلاف شخص ممن بقوا أعضاء في هذه الخطة الصحية في عام 1994 ، بعد إصدار تشخيصات العيادات الخارجية المحوسبة للخرف (كل من مرض الزهايمر والخرف الوعائي). تراوحت أعمار الأشخاص بين 40 و 45 عامًا عندما تم جمع بيانات الكوليسترول.
وجد الباحثون نتيجة ذات دلالة إحصائية بالكاد تشير إلى أن الأشخاص الذين تم تشخيص إصابتهم بمرض الزهايمر لديهم نسبة كوليسترول أعلى في خمسينياتهم من المجموعة الضابطة. كانت القيمة المتوسطة لمرضى الزهايمر 228.5 ، مقابل 224.1 للمجموعة الضابطة.
السؤال الذي يجب على الجميع طرحه هو: بالنسبة لمجموعة مرض الزهايمر ، كيف تكدس الأشخاص الذين تناولوا العقاقير المخفضة للكوليسترول فيما بعد ضد الأشخاص الذين لم يفعلوا ذلك؟ في الاستخفاف الشديد ، لاحظ المؤلفون بلا هوادة في منتصف فقرة: "لم تكن المعلومات حول علاجات خفض الدهون ، والتي تم اقتراحها لتقليل خطر الخرف [31] ، متاحة لهذه الدراسة". يمكنك أن تكون على يقين من أنه إذا كان هناك أي حبر قد تكون العقاقير المخفضة للكوليسترول قد ساعدت ، فسيتم السماح لهؤلاء الباحثين بالوصول إلى هذه البيانات.
المقالة التي يشيرون إليها للدعم ، مرجع [19] في [46] (وهو مرجع [44] هنا) كان ضعيفًا جدًا. يتكرر الملخص لهذه المقالة بالكامل هنا في الملحق. لكن الجملة الختامية تلخصها بشكل جيد: "يبدو أن دور الستاتين المتواضع أكثر من مجرد دور متواضع في الوقاية من مرض الزهايمر". هذا هو أفضل ما يمكنهم التوصل إليه للدفاع عن الموقف الذي قد تحميه العقاقير المخفضة للكوليسترول من مرض الزهايمر.
تفسير بديهي لسبب ارتفاع نسبة الكوليسترول في سن مبكرة قد يكون مرتبطًا بمخاطر مرض الزهايمر يتعلق بـ apoE-4. من المعروف أن الأشخاص الذين لديهم هذا الأليل يعانون من ارتفاع نسبة الكوليسترول في الحياة في وقت مبكر [39] ، وأعتقد أن هذه استراتيجية وقائية من جانب الجسم. من المحتمل أن يكون أليل apoE-4 معيبًا في مهمة استيراد الكوليسترول إلى الخلايا النجمية ، وبالتالي فإن زيادة التوافر البيولوجي للكوليسترول في مصل الدم سيساعد على تعويض هذا العجز. سيكون تناول الستاتين هو آخر شيء يريد الشخص في هذا الموقف القيام به.
5. هل تسبب العقاقير المخفضة للكوليسترول مرض الزهايمر؟
هناك سبب واضح لماذا ستعزز العقاقير المخفضة للكوليسترول من مرض الزهايمر. إنهم يعوقون قدرة الكبد على تخليق الكوليسترول ، وبالتالي مستوى LDL في هبوط الدم. يلعب الكوليسترول دورًا مهمًا في الدماغ ، سواء من حيث تمكين نقل الإشارات عبر المشبك [50] ومن حيث تشجيع نمو الخلايا العصبية من خلال التطور الصحي لغمد المايلين [45]. ومع ذلك ، تفتخر صناعة الستاتين بفخر أن الستاتينات فعالة في التدخل في إنتاج الكوليسترول في الدماغ [31] [47] وكذلك في الكبد.
Yeon-Kyun Shin هو خبير في الآلية الفيزيائية للكوليسترول في المشبك لتعزيز نقل الرسائل العصبية ، وقد أشار أحد مؤلفي [50] في وقت سابق. قال شين في مقابلة أجراها معه مراسل "ساينس ديلي": "إذا حرمت الكوليسترول من الدماغ ، فأنت تؤثر بشكل مباشر على الآلية التي تؤدي إلى إطلاق الناقلات العصبية. الناقلات العصبية تؤثر على وظائف معالجة البيانات والذاكرة. وبعبارة أخرى - كيف أنت ذكي ومدى تذكر الأشياء ".
أظهرت مراجعة حديثة لدراستين كبيرتين تعتمدان على تعمية مزدوجة مضبوطة بالسيطرة على أدوية الستاتين لدى الأفراد المعرضين لخطر الإصابة بالخرف ومرض الزهايمر أن العقاقير المخفضة للكوليسترول ليست واقية من مرض الزهايمر [34]. نقلت صحيفة ساينس ديلي عن المؤلفة الرئيسية للدراسة برناديت ماكغينيس قوله "من هذه التجارب التي تحتوي على أعداد كبيرة جدًا وكانت المعيار الذهبي - يبدو أن العقاقير المخفضة للكوليسترول التي تم تقديمها في أواخر الحياة للأفراد المعرضين للخطر من أمراض الأوعية الدموية لا تمنع من الخرف ". عندما طُلب من بياتريس غولومب ، باحثة في جامعة كاليفورنيا ، أن تكون أكثر سلبية ، قائلة: "فيما يتعلق بالعقاقير المخفضة للكوليسترول كأدوية وقائية ، هناك عدد من الحالات الفردية في تقارير الحالة وسلسلة الحالات التي يكون فيها الإدراك .بشكل واضح ومتكرر تتأثر الستاتين ". في المقابلة ، لاحظ غولومب أن التجارب العشوائية المختلفة أظهرت أن العقاقير المخفضة للكوليسترول كانت إما سلبية أو محايدة تجاه الإدراك ، ولكن لم يظهر أي منها استجابة إيجابية.
أحد الآثار الجانبية الشائعة للستاتين هو ضعف الذاكرة. دوان جرافلين ، المعروف باسم "spacedoc" لأنه خدم كطبيب لرواد الفضاء ، كان مدافعًا قويًا ضد العقاقير المخفضة للكوليسترول على صفحته على الويب حيث يقوم بجمع أدلة على الآثار الجانبية للعقاقير المخفضة للكوليسترول مباشرة من مستخدمي الستاتين حول العالم. قاد إلى هذا الاعتداء على العقاقير المخفضة للكوليسترول كنتيجة لتجربته الشخصية لفقدان الذاكرة العالمية العابرة ، وهي حلقة مخيفة من فقدان الذاكرة الكلي الذي يعتقد أنه سببه أدوية الستاتين التي كان يتناولها في ذلك الوقت. أكمل الآن ثلاثة كتب تصف مجموعة متنوعة من الآثار الجانبية المدمرة للعقاقير المخفضة للكوليسترول ، وأشهرها ليبيتور: لص الذاكرة [17].
الطريقة الثانية (إلى جانب تأثيرها المباشر على الكوليسترول) التي من المحتمل أن تؤثر فيها العقاقير المخفضة للكوليسترول على مرض الزهايمر في تأثيرها السلبي غير المباشر على توريد الأحماض الدهنية ومضادات الأكسدة إلى الدماغ. من المسلم به أن العقاقير المخفضة للكوليسترول تقلل بشكل كبير من مستوى LDL في مصل الدم. هذا هو ادعاءهم بالشهرة. ومع ذلك ، من المثير للاهتمام أنهم نجحوا في تقليل ليس فقط كمية الكوليسترول الموجودة في جزيئات LDL ، بل العدد الفعلي لجزيئات LDL تمامًا. وهذا يعني أنه بالإضافة إلى استنفاد الكوليسترول ، فإنها تقلل من الإمداد المتاح للدماغ لكل من الأحماض الدهنية ومضادات الأكسدة ، والتي يتم حملها أيضًا في جزيئات LDL. كما رأينا ، كل هذه المواد الثلاثة ضرورية لعمل الدماغ السليم.
أفترض أن أسباب هذا التأثير غير المباشر ذات شقين: (1) عدم وجود ما يكفي من الكوليسترول في الصفراء لاستقلاب الدهون الغذائية ، و (2) تأثير الحد من المعدل على إنتاج LDL هو القدرة على توفير الكوليسترول الكافي في القشرة لضمان بقاء المحتويات أثناء النقل في مجرى الدم ؛ بمعنى حماية المحتويات من الأكسدة والبكتيريا والفيروسات. غالبًا ما ينتهي الأشخاص الذين يتناولون أعلى جرعة 80 ملجم / ديسيلتر من العقاقير المخفضة للكوليسترول بمستويات LDL منخفضة تصل إلى 40 ملجم / ديسيلتر ، أقل بكثير حتى من أقل الأرقام التي لوحظت بشكل طبيعي. أرتجف من التفكير في العواقب المحتملة طويلة الأمد لمثل هذا النضوب الشديد في الدهون والكوليسترول ومضادات الأكسدة.
الطريقة الثالثة التي يمكن فيها للستاتين تعزيز مرض الزهايمر هي شل قدرة الخلايا على تركيب الإنزيم المساعد Q10. من سوء حظ مشاركة الإنزيم المساعد Q10 هو نفس مسار التمثيل الغذائي مثل الكوليسترول. تتداخل أدوية الستاتين مع خطوة وسيطة حاسمة على طريق تخليق كل من الكوليسترول والإنزيم المساعد Q10. يُعرف إنزيم Q10 أيضًا باسم "ubiquinone" لأنه يبدو أنه يظهر في كل مكان في استقلاب الخلية. تم العثور عليه في كل من الميتوكوندريا واللايسوزومات ، ودوره الحاسم في كلا المكانين هو كمضاد للأكسدة. يتم تحلل الاسترات الخاملة لكل من الكوليسترول والأحماض الدهنية وتنشيطها في الليزوزومات [8] ، ثم يتم إطلاقها في السيتوبلازم. يستهلك Coenzyme Q10 الأكسجين الزائد لمنعه من التلف التأكسدي [30] ، بينما يولد أيضًا الطاقة في شكل ATP (أدينوزين ثلاثي الفوسفات ، عملة الطاقة العالمية في علم الأحياء).
الطريقة الأخيرة التي يجب أن تزيد فيها العقاقير المخفضة للكوليسترول من خطر الإصابة بمرض الزهايمر هي من خلال تأثيرها غير المباشر على فيتامين د  يتم تصنيع فيتامين د من الكوليسترول في الجلد ، عند التعرض لأشعة الشمس فوق البنفسجية. في الواقع ، لا يمكن تمييز الصيغة الكيميائية لفيتامين D تقريبًا عن تلك الخاصة بالكوليسترول ، كما هو موضح في الشكلين المرفقين (الكوليسترول على اليسار ، فيتامين د على اليمين). إذا كانت مستويات LDL
يتم تصنيع فيتامين د من الكوليسترول في الجلد ، عند التعرض لأشعة الشمس فوق البنفسجية. في الواقع ، لا يمكن تمييز الصيغة الكيميائية لفيتامين D تقريبًا عن تلك الخاصة بالكوليسترول ، كما هو موضح في الشكلين المرفقين (الكوليسترول على اليسار ، فيتامين د على اليمين). إذا كانت مستويات LDL
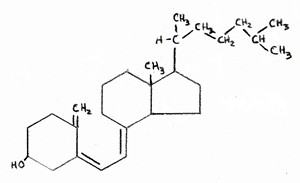
منخفضة ، فعندئذ لن يكون الجسم قادرًا على إعادة إمداد كميات كافية من الكوليسترول لتجديد المخازن في الجلد بمجرد استنفادها. سيؤدي ذلك إلى نقص فيتامين د ، وهو مشكلة واسعة الانتشار في
أمريكا.
من المعروف أن فيتامين د يحارب العدوى. على حد تعبير [25] ، "المرضى الذين يعانون من التهابات شديدة كما في الإنتان لديهم نسبة عالية من نقص فيتامين د ومعدلات وفيات عالية." كما سيتم توضيحه لاحقًا ، فقد ثبت وجود عدد كبير من العوامل المعدية بكميات كبيرة بشكل غير طبيعي في أدمغة مرضى الزهايمر [27] [26].
جادل الدكتور جرانت مؤخرًا [16] بأن هناك العديد من خطوط الأدلة التي تشير إلى فكرة أن الخرف مرتبط بنقص فيتامين د. الحجة غير المباشرة هي أن نقص فيتامين د مرتبط بالعديد من الحالات التي تحمل بدورها خطرًا متزايدًا للخرف ، مثل مرض السكري والاكتئاب وهشاشة العظام وأمراض القلب والأوعية الدموية. تنتشر مستقبلات فيتامين د على نطاق واسع في الدماغ ، ومن المحتمل أن تلعب دورًا هناك في محاربة العدوى. يلعب فيتامين د بالتأكيد أدوارًا حيوية أخرى في الدماغ أيضًا ، على النحو الذي اقترحه بقوة هذا الاقتباس المأخوذ من خلاصة [32]: "نستنتج أن هناك أدلة بيولوجية كثيرة تشير إلى دور مهم لفيتامين د في نمو الدماغ ووظيفته. "
6. الخلايا النجمية واستقلاب الجلوكوز والأكسجين
يرتبط مرض الزهايمر بشكل واضح بنقص في توريد الدهون والكوليسترول إلى الدماغ. IDL ، عندما يعمل بشكل صحيح ، هو في الواقع فعال بشكل لا يصدق في إنتاج الكولسترول والدهون من الدم عبر أغشية الخلايا ، مقارنة بـ LDL [8]. إنها تتخلى عن محتوياتها بسهولة أكبر من لعبة apo الأخرى. ويحقق ذلك كنتيجة مباشرة لـ apoE. ينقل IDL (وكذلك LDL) في الدم الدهون والكوليسترول إلى الخلايا النجمية في الدماغ ، وبالتالي يمكن للخلايا النجمية استخدام هذا المصدر الخارجي بدلاً من الاضطرار إلى إنتاج هذه العناصر الغذائية نفسها. أظن ، في الواقع ، أن الخلايا النجمية لا تنتج إلا إمدادات خاصة عندما يكون العرض الخارجي غير كافٍ ، وهم يفعلون ذلك على مضض.
لماذا يكون من غير المواتي أن تقوم الخلايا النجمية بتجميع الدهون الخاصة بها والكوليسترول؟ في رأيي ، فإن الجواب يتعلق بالأكسجين. تحتاج الخلايا النجمية إلى مصدر طاقة مهم لتجميع الدهون والكوليسترول ، وعادة ما يتم توفير هذه الطاقة عن طريق الجلوكوز من مجرى الدم. علاوة على ذلك ، فإن المنتج النهائي لاستقلاب الجلوكوز هو أسيتيل- Coenzyme A ، وهو مقدمة للأحماض الدهنية والكوليسترول. يمكن استهلاك الجلوكوز بكفاءة عالية في الميتوكوندريا ، وهي الهياكل الداخلية داخل الخلية السيتوبلازم ، عن طريق العمليات الهوائية التي تتطلب الأكسجين. يتم تكسير الجلوكوز لإنتاج أسيتيل إنزيم A كمنتج نهائي ، بالإضافة إلى ATP ، مصدر الطاقة في جميع الخلايا.
ومع ذلك ، الأكسجين سام للدهون (الدهون) ، لأنه يؤكسدها ويجعلها فاسدة. تكون الدهون هشة إذا لم يتم تغليفها في غلاف واقٍ مثل IDL أو HDL أو LDL. وبمجرد أن يصبحوا فاسدين ، يصبحون عرضة للإصابة بالعوامل الغازية مثل البكتيريا والفيروسات. لذا ، يجب أن تكون الخلايا النجمية التي تحاول تجميع الدهون دقيقة للغاية للحفاظ على الأكسجين ، ولكن الأكسجين ضروري لعملية التمثيل الغذائي الفعالة للجلوكوز ، والتي ستوفر الوقود (ATP) والمواد الخام (أسيتيل-إنزيم A) للدهون و تخليق الكولسترول.
ماذا أفعل؟ حسنًا ، اتضح أن هناك حلًا بديلاً ، على الرغم من أنه أقل كفاءة ، وهو: استقلاب الجلوكوز اللاهوائي مباشرة في السيتوبلازم. لا تعتمد هذه العملية على الأكسجين (ميزة كبيرة) ولكنها تنتج أيضًا كمية أقل بكثير من ATP (فقط 6 ATP على النقيض من 30 إذا تم استقلاب الجلوكوز هوائيًا في الميتوكوندريا). المنتج النهائي لهذه الخطوة اللاهوائية هو مادة تسمى البيروفات ، والتي يمكن أن تتفكك أكثر لتنتج المزيد من الطاقة ، ولكن هذه العملية لا يمكن الوصول إليها من قبل جميع الخلايا ، وتبين أن الخلايا النجمية بحاجة إلى المساعدة لتحقيق ذلك ، وهنا يأتي دور أميلويد بيتا.
7. الدور الحاسم لأميلويد بيتا
Amyloid-beta (المعروف أيضًا باسم "abeta") هو المادة التي تشكل اللوحة الشهيرة التي تتراكم في أدمغة مرضى الزهايمر. يعتقد الكثيرون (ولكن ليس جميعهم) في مجتمع البحث أن الأميلويد بيتا هو السبب الرئيسي لمرض الزهايمر ، ونتيجة لذلك ، يبحث الباحثون بنشاط عن الأدوية التي قد تدمره. ومع ذلك ، فإن amyloid-beta لديه القدرة الفريدة على تحفيز إنتاج إنزيم ديهيدروجيناز اللاكتات ، الذي يعزز تحلل البيروفات (منتج استقلاب الجلوكوز اللاهوائي) إلى اللاكتات ، من خلال عملية التخمير اللاهوائي ، وتجديد NAD + وتمكين المزيد من الإنتاج لكمية كبيرة من ATP من خلال تحلل السكر الإضافي.
يمكن أن تستخدم اللاكتات بدورها كمصدر للطاقة من قبل بعض الخلايا ، وقد ثبت أن الخلايا العصبية موجودة في القائمة القصيرة لأنواع الخلايا التي يمكنها استقلاب اللاكتات. لذا أفترض أن اللاكتات تنتقل من الخلايا النجمية إلى الخلايا العصبية المجاورة لتعزيز إمدادها بالطاقة ، وبالتالي تقليل اعتمادها على الجلوكوز. من المعروف أيضًا أن apoE يمكن أن يشير إلى إنتاج أميلويد بيتا ، ولكن فقط في ظل ظروف بيئية معينة غير مفهومة. أقترح أن هذه المحفزات البيئية لها علاقة بالتصنيع الداخلي للدهون والكوليسترول في مقابل استخراج هذه العناصر الغذائية من إمدادات الدم. على سبيل المثال ، يتم إنتاج أميلويد-بيتا نتيجة الإجهاد التأكسدي البيئي بسبب عدم كفاية إمدادات الدهون والكوليسترول من الدم.
بالإضافة إلى استخدامه كمصدر للطاقة عن طريق تحطيمه إلى اللاكتات ، يمكن أيضًا استخدام البيروفات ككتلة بناء أساسية لتوليف الأحماض الدهنية. لذا فإن استقلاب الجلوكوز اللاهوائي ، الذي ينتج البيروفات ، هو وضع مربح للجانبين: (1) يقلل بشكل كبير من خطر تعرض الأحماض الدهنية للأكسجين ، (2) يوفر مصدرًا للوقود للخلايا العصبية المجاورة في شكل اللاكتات (3) يوفر لبنة أساسية لتركيب الأحماض الدهنية. لكن ذلك يعتمد على عمل أميلويد بيتا.
وهكذا ، من وجهة نظري (وفي رأي الآخرين [28] [20] Amyloid-Beta و alzheimer) ، amyloid-beta ليس سببًا لمرض الزهايمر ، بل هو وسيلة حماية ضده. ويرد ملخص المرجع [28] الذي يناقش وجهة النظر هذه بالكامل في الملحق. تم تحديد العديد من متغيرات العيب الجيني المرتبط ببروتين السلائف الأميلويد (APP) ، وهو البروتين الذي يتم اشتقاق منه أميلويد بيتا. من المحتمل أن يؤدي خلل في هذا البروتين ، المرتبط بزيادة خطر الإصابة بمرض الزهايمر مبكرًا ، إلى انخفاض القدرة على توليف بيتا أميلويد بيتا ، مما قد يترك الدماغ مع مشكلة كبيرة ، لأن الوقود والمبنى الأساسي سيكون هناك نقص في كتل تصنيع الأحماض الدهنية ، في حين أن رحلات الأكسجين عبر الخلية إلى الميتوكوندريا ستعرض أيًا من الدهون التي يتم تصنيعها للأكسدة. من المحتمل أن تكون الخلية غير قادرة على مواكبة الحاجة ، وهذا سيؤدي إلى انخفاض في عدد الأحماض الدهنية في السائل الدماغي الشوكي الدماغي الزهايمر ، وهي خاصية راسخة لمرض الزهايمر [38].
8. دور الكوليسترول في الدماغ
يحتوي الدماغ على 2٪ فقط من إجمالي وزن الجسم ، ومع ذلك فهو يحتوي على ما يقرب من 25٪ من إجمالي الكوليسترول في الجسم. تم تحديد أن العامل المحدد الذي يسمح بنمو المشابك هو توافر الكوليسترول الذي توفره الخلايا النجمية. يلعب الكوليسترول دورًا مهمًا للغاية في المشبك ، عن طريق تشكيل أغشية الخلايا في نوبة مريحة بحيث يمكن أن تقفز الإشارة بسهولة عبر المشبك [50]. لذا فإن الكوليسترول غير الكافي في المشبك سيضعف الإشارة في البداية ، كما أن طلاء الدهون غير الكافي في غشاء المايلين سيضعفها ويبطئها أثناء النقل. إن العصبون الذي لا يستطيع إرسال رسائله هو خلية عصبية عديمة الفائدة ، ومن المنطقي فقط تقليمها والتخلص من محتوياتها.
تقع الخلايا العصبية التالفة في مرض الزهايمر في مناطق معينة من الدماغ مرتبطة بالذاكرة والتخطيط عالي المستوى. تحتاج هذه الخلايا العصبية إلى إرسال إشارات لمسافات طويلة بين القشرة الأمامية والجبهة الأمامية والحُصين ، الموجود في الدماغ المتوسط. يعتمد نقل هذه الإشارات على اتصال قوي وضيق في المشبك ، حيث يتم نقل الإشارة من عصبون إلى آخر ، وانتقال آمن عبر الألياف العصبية الطويلة ، وهي جزء من المادة البيضاء. يتكون غمد المايلين الذي يكسو الألياف العصبية بشكل رئيسي من الأحماض الدهنية ، إلى جانب تركيز كبير من الكوليسترول. إذا لم يتم عزله جيدًا ، فسيتباطأ معدل إرسال الإشارة وستنخفض قوة الإشارة بشدة. يعتبر الكوليسترول أمرًا حاسمًا بالنسبة للميالين وكذلك المشبك ، كما هو موضح بشكل كبير من خلال التجارب التي أجريت على الفئران المعيبة وراثيًا بواسطة Gesine Saher et al. [45]. تفتقر هذه الفئران الطافرة إلى القدرة على تخليق الكوليسترول في خلايا oligodendrocytes المكونة للميلين. لقد أزعجوا الميالين بشدة في أدمغتهم ، وأظهروا رنحًا (حركات عضلية غير منسقة) ورعاش. في الملخص ، كتب المؤلفون بشكل لا لبس فيه ، "هذا يظهر أن الكوليسترول هو عنصر لا غنى عنه في أغشية المايلين".
يميل الأشخاص الذين لديهم أليل apoE-4 إلى ارتفاع نسبة الكوليسترول في الدم. تم تناول مسألة ما إذا كان هذا المستوى العالي من الكوليسترول محاولة من جانب الجسم للتكيف مع معدل ضعيف لامتصاص الكوليسترول في الدماغ من قبل فريق من الباحثين في عام 1998 [39]. قاموا بدراسة 444 رجلاً تتراوح أعمارهم بين 70 و 89 عامًا في ذلك الوقت ، والذين كانت هناك سجلات مكثفة لمستويات الكوليسترول التي يعود تاريخها إلى عدة عقود مضت. والأهم من ذلك ، انخفضت مستويات الكوليسترول لدى الرجال الذين أصيبوا بمرض الزهايمر قبل ظهور أعراض مرض الزهايمر. اقترح المؤلفون أن ارتفاع نسبة الكوليسترول لديهم ربما كان آلية وقائية ضد مرض الزهايمر.
قد يتساءل المرء لماذا انخفضت مستويات الكوليسترول لديهم. لم يكن هناك ذكر لأدوية العقاقير المخفضة للكوليسترول في المقالة ، ولكن من المؤكد أن العقاقير المخفضة للكوليسترول ستكون وسيلة فعالة لخفض مستويات الكوليسترول. تود صناعة الستاتين أن يعتقد الناس أن ارتفاع الكوليسترول هو عامل خطر لمرض الزهايمر ، وهم سعداء للغاية لأن ارتفاع نسبة الكوليسترول في وقت مبكر من الحياة يرتبط بمرض الزهايمر في وقت لاحق. لكن هذه النتائج تشير إلى عكس ذلك تمامًا: أن مستويات الكوليسترول في الدم يتم الاحتفاظ بها عالية عن قصد من قبل الآليات التنظيمية للجسم في محاولة لتعويض العيب. سيؤدي التركيز العالي إلى زيادة معدل الولادة إلى الدماغ ، حيث تكون هناك حاجة ماسة للحفاظ على غشاء المايلين صحيًا وتعزيز إشارات الخلايا العصبية في المشابك.
باستخدام تقنية التصوير بالرنين المغناطيسي ، تمكن الباحثون في UCLA من قياس درجة انهيار الميلين في مناطق محددة من الدماغ [6]. أجروا دراساتهم على أكثر من 100 شخص تتراوح أعمارهم بين 55 و 75 عامًا ، والذين قرروا أيضًا أليل apoE المرتبط بها (2 أو 3 أو 4). ووجدوا اتجاهًا ثابتًا في أن apoE-2 كان أقل قدر من التدهور ، وكان apoE-4 هو الأكثر ، في منطقة الفص الجبهي للدماغ. جميع الأشخاص في الدراسة كانوا أصحاء حتى الآن فيما يتعلق بمرض الزهايمر. تظهر هذه النتائج أن الانهيار المبكر لغمد المايلين (على الأرجح بسبب عدم كفاية إمدادات الدهون والكوليسترول لإصلاحه) يرتبط بـ apoE-4.
للتلخيص ، أفترض أنه بالنسبة لمرضى الزهايمر apoE-4 ، أدى apoE المعيب إلى ضعف القدرة على نقل الدهون والكوليسترول من مجرى الدم ، عن طريق الخلايا النجمية ، إلى السائل النخاعي. ارتفاع نسبة الكولسترول في الدم المصاحب هو محاولة لتصحيح هذا الخلل جزئيًا. بالنسبة لبقية مرضى الزهايمر (أولئك الذين ليس لديهم أليل apoE-4 ولكن لديهم أيضًا أحماض دهنية مستنفدة بشدة في السائل الدماغي الشوكي) ، علينا أن نبحث عن سبب آخر لكسر سلسلة توريد الأحماض الدهنية.
9. الالتهابات والالتهابات
لتلخيص ما قلته حتى الآن ، يبدو أن الزهايمر ناتج عن عدم قدرة الخلايا العصبية على العمل بشكل صحيح ، بسبب نقص الدهون والكوليسترول. تتمثل المشكلة المركبة في أن الدهون بمرور الوقت ستصبح فاسدة إذا لم يتم تجديدها بشكل كافٍ. الدهون الفاسدة عرضة للهجوم من قبل الكائنات الحية الدقيقة مثل البكتيريا والفيروسات. Amyloid-beta هو جزء من الحل لأنه يسمح للخلايا النجمية أن تكون أكثر فعالية في استخدام الجلوكوز اللاهوائي ، والذي يحمي الدهون الاصطناعية والكوليسترول من التعرض للأكسجين السام ، بينما يوفر في نفس الوقت الطاقة التي تحتاجها كل من الخلايا النجمية عملية التوليف ومن قبل الخلايا العصبية المجاورة لتغذية إطلاق الإشارات.
بالإضافة إلى الخلايا النجمية ، فإن الخلايا الدبقية الصغيرة في الدماغ متورطة أيضًا في مرض الزهايمر. تقوم الخلايا الدبقية الصغيرة بتحفيز نمو الخلايا العصبية عندما يكون كل شيء على ما يرام ، ولكنها تؤدي إلى موت الخلايا المبرمجة للخلايا العصبية في وجود مواد سامة تفرزها البكتيريا مثل السكريات [56]. سوف تفرز Microglia بشكل دفاعي السيتوكينات (إشارات الاتصال التي تعزز الاستجابة المناعية) عند التعرض للعوامل المعدية ، وهذه بدورها ستؤدي إلى الالتهاب ، وهي ميزة أخرى معروفة مرتبطة بمرض الزهايمر [1]. الخلايا الدبقية الصغيرة قادرة على التحكم فيما إذا كانت الخلايا العصبية يجب أن تعيش أو تموت ، وهي بالتأكيد تعتمد على هذا القرار على العوامل المتعلقة بمدى عمل الخلايا العصبية وما إذا كانت مصابة. بمجرد أن تتم برمجة ما يكفي من الخلايا العصبية لموت الخلايا ، فإن المرض سيظهر على أنه تراجع إدراكي.
10. دليل على أن العدوى مرتبطة بمرض الزهايمر
هناك أدلة قوية على أن مرض الزهايمر مرتبط بزيادة احتمالية ظهور عوامل معدية في الدماغ. يعتقد بعض الباحثين أن العوامل المعدية هي السبب الرئيسي لمرض الزهايمر. هناك عدد من البكتيريا الموجودة في الجهاز الهضمي البشري ويمكن أن تتعايش مع خلايانا دون أي ضرر. ومع ذلك ، فقد ثبت مؤخرا أن H. pylori ، وهو أمر شائع جدا ، مسؤول عن قرحة المعدة. تم الاشتباه في أن الملوية البوابية قد تكون متورطة في مرض الزهايمر ، وبالفعل ، أظهرت دراسة حديثة أن مرضى الزهايمر لديهم تركيز أعلى بكثير من الأجسام المضادة ضد الملوية البوابية في كل من السائل الدماغي الشوكي ودمائهم من الضوابط غير الزهايمر [26]. تم الكشف عن بكتيريا الملوية البوابية في 88 ٪ من مرضى الزهايمر ولكن فقط 47 ٪ من الضوابط. في محاولة لعلاج مرضى الزهايمر ، أجرى الباحثون توليفة قوية من المضادات الحيوية ، وقيَّموا درجة التدهور العقلي على مدى العامين المقبلين [27]. بالنسبة لـ 85 ٪ من المرضى ، تم توجيه العدوى بنجاح ، وبالنسبة لهؤلاء المرضى ، تم الكشف عن التحسن المعرفي أيضًا بعد مرور عامين. لذلك كان هذا مثالًا لطيفًا على إمكانية علاج مرض الزهايمر من خلال المضادات الحيوية.
الالتهاب الرئوي هو بكتيريا شائعة جدا ، يقدر أنها تصيب 40-70 ٪ من البالغين. ولكن هناك فرق كبير بين وجود بكتيريا في مجرى الدم وشق طريقها إلى الحرم الداخلي للدماغ. كشفت دراسة لعينات ما بعد الوفاة من مناطق مختلفة من أدمغة مرضى الزهايمر وضوابط غير الزهايمر إحصائية مختلفة بشكل ملحوظ: 17 من أصل 19 أدمغة الزهايمر تم اختبارها إيجابية للبكتيريا ، في حين أن 1 فقط من أصل 19 دماغًا من المجموعة الضابطة اختبار إيجابي [5].
تم العثور على العديد من العوامل المعدية الأخرى ، على حد سواء الفيروسات والبكتيريا ، مرتبطة بمرض الزهايمر ، بما في ذلك فيروس الهربس البسيط ، فيروس بيكورنا ، فيروس مرض بورنا ، والسبيروتشيتي [23]. كان أحد الاقتراحات أن عاثية بكتيريا معينة - فيروس يصيب بكتيريا الالتهاب الرئوي - قد تكون مسؤولة عن مرض الزهايمر [14]. جادل المؤلفون بأن العاثيات قد تشق طريقها إلى الميتوكوندريا للخلية المضيفة وبعد ذلك تبدأ الزهايمر.
11. النظام الغذائي الكيتوني كعلاج لمرض الزهايمر
أحد النماذج العلاجية الواعدة الجديدة لمرض الزهايمر هو تحويل المريض إلى نظام غذائي عالي الدهون ومنخفض الكربوهيدرات ، وهو ما يسمى بنظام غذائي "الكيتون". يأتي الاسم من حقيقة أن عملية التمثيل الغذائي للدهون الغذائية تنتج "أجسام كيتون" كمنتج ثانوي ، وهي مصدر مفيد للغاية لعملية التمثيل الغذائي في الدماغ. أصبح من الواضح بشكل متزايد أن استقلاب الجلوكوز المعيب في الدماغ (ما يسمى "مرض السكري من النوع 3") هو سمة مبكرة لمرض الزهايمر. يمكن توصيل أجسام الكيتون ، سواء دخلت إلى الخلية النجمية مباشرة أو تم إنتاجها في الخلية النجمية نفسها عن طريق تحطيم الدهون ، إلى الخلايا العصبية المجاورة ، كما هو موضح في المصاحبة
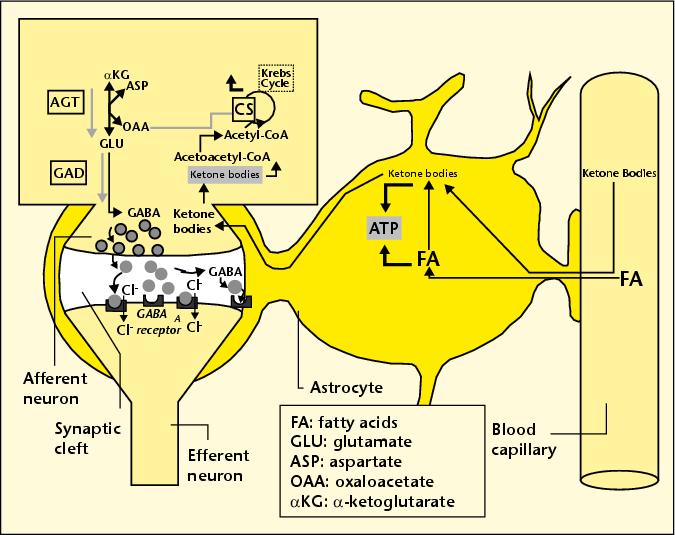
الشكل. يمكن أن تستخدم هذه الخلايا العصبية أجسام الكيتون كمصدر للطاقة (استبدال الجلوكوز وبالتالي تخفيفه) وكمصدر لـ GABA ، وهو ناقل عصبي مهم منتشر في الدماغ.
تم العثور على دليل على أن النظام الغذائي الكيتوني قد يساعد مرض الزهايمر لأول مرة من خلال البحث الذي أجري على الفئران التي تم تربيتها لتكون عرضة لمرض الزهايمر [21]. وجد الباحثون أن إدراك الفئران تحسن عندما تم علاجهم بنظام غذائي منخفض الدهون منخفض الكربوهيدرات ، وكذلك تم تقليل كمية بيتا أميلويد في الدماغ. يمكن توقع التأثير الأخير بناءً على الفرضية القائلة بأن الأميلويد بيتا يعزز الاستخدام الكامل للجلوكوز اللاهوائي ، كما ناقشت سابقًا. عن طريق الحصول على أجسام كيتون كمصدر إضافي للوقود ، يتم تقليل الاعتماد على الجلوكوز. ولكن هناك تأثير آخر قد يكون أكثر أهمية من ذلك هو توافر الدهون عالية الجودة لتحسين حالة غمد المايلين.
هذه الفكرة مدعومة بتجارب أخرى أجريت على مرضى الزهايمر البشري [11] [42]. دراسة مضبوطة بالغفل عام 2004 [42] حول تأثير إثراء الدهون الغذائية على مرض الزهايمر مفيدة بشكل خاص ، لأنها كشفت عن اختلاف كبير في فعالية تخصيب الدهون بالنسبة للأشخاص الذين لم يكن لديهم أليل apoE-4 مقارنة مع أولئك من فعل. أعطيت مجموعة الاختبار التجريبي مشروبًا تكميليًا يحتوي على الدهون الثلاثية متوسطة السلسلة المستحلبة ، الموجودة بتركيز عالٍ في زيت جوز الهند. أظهر الأشخاص الذين ليس لديهم أليل apoE-4 تحسنًا كبيرًا في النتيجة في اختبار قياسي لمرض الزهايمر ، في حين أن الأشخاص الذين لديهم أليل apoE-4 لم يفعلوا ذلك. هذا مؤشر قوي على أن الفائدة قد تكون مرتبطة بزيادة امتصاص الخلايا النجمية لهذه الدهون عالية الجودة ، وهو أمر لا يستطيع الأشخاص الذين لديهم أليل apoE-4 تحقيقه بسبب خلل في آليات نقل IDL و LDL .
12. علاج NADH: الدور الحاسم لمضادات الأكسدة
يعد الإنزيم المساعد NADH (نيكوتيناميد الأدينين ثنائي النوكليوتيد) أحد العلاجات الواعدة القليلة لمرض الزهايمر [12]. في دراسة مضبوطة بالغفل ، أظهرت مواضيع مرض الزهايمر التي أُعطيت NADH لمدة ستة أشهر أداءً أفضل بكثير في الطلاقة اللفظية والقدرة البنائية البصرية والاستدلال اللفظي المجرد من الأشخاص الخاضعين للتحكم الوهمي.
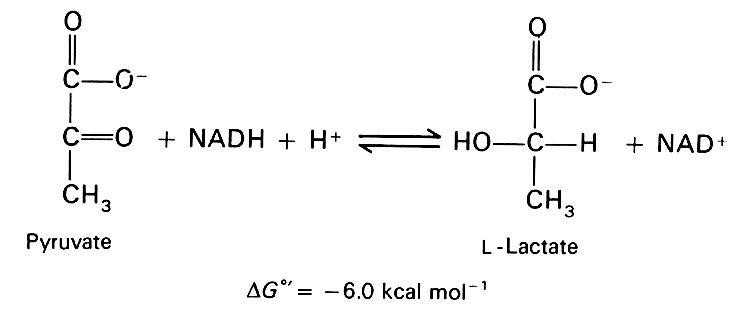
لماذا يكون NADH فعالاً؟ في عملية تحويل البيروفات إلى لاكتات ، يستهلك ديهيدروجيناز اللاكتات الأكسجين عن طريق أكسدة NADH إلى NAD + ، كما هو موضح في الشكل المصاحب. لذا ، إذا تم زيادة التوافر الحيوي لـ NADH ، فمن المنطقي أن تكون الخلية النجمية قادرة على تحويل البيروفات إلى اللاكتات ، وهي الخطوة الحاسمة في مسار التمثيل الغذائي اللاهوائي الذي يتم تعزيزه بواسطة amyloid-beta. ستقلل العملية ، عن طريق امتصاص الأكسجين السام ، من تلف الدهون بسبب التعرض للأكسجين ، وستوفر أيضًا اللاكتات كمصدر للطاقة للخلايا العصبية.
13. التعرض المفرط للأكسجين والانحدار المعرفي
وقد لوحظ أن بعض كبار السن يعانون من تدهور إدراكي مؤقت وأحيانًا دائم بعد عملية طويلة. اشتبه باحثون في جامعة جنوب فلوريدا وجامعة فاندربيلت أن هذا قد يكون بسبب التعرض المفرط للأكسجين [4]. عادة ، أثناء العملية ، غالبًا ما يتم إعطاء الأشخاص جرعات عالية من الأكسجين ، حتى 100٪ من الأكسجين. أجرى الباحثون تجربة على فئران صغار البالغين ، تم تصميمها لتكون مهيأة تجاه مرض الزهايمر ولكنها لم تعاني بعد من التدهور المعرفي. لكن لديهم بالفعل رواسب أميلويد بيتا في أدمغتهم. تعرضت الفئران التي أعيد تصميمها ، وكذلك مجموعة التحكم التي لم يكن لديها جين قابلية الإصابة بمرض الزهايمر ، إلى أكسجين بنسبة 100 في المائة لمدة ثلاث ساعات ، ثلاث مرات على مدار عدة أشهر ، لمحاكاة العمليات المتكررة. ووجد الباحثون أن الفئران التي سبق التخلص منها من مرض الزهايمر عانت من انخفاض إدراكي كبير بعد التعرض للأكسجين ، على النقيض من الفئران الضابطة.
هذا مؤشر قوي على أن التعرض المفرط للأكسجين أثناء العمليات يسبب تلفًا تأكسديًا في دماغ الزهايمر. بالنظر إلى الحجج التي قدمتها أعلاه ، فإن هذه النتيجة منطقية. الدماغ ، عن طريق التحول إلى التمثيل الغذائي اللاهوائي لتوليد الطاقة (بمساعدة amyloid-beta) يبذل قصارى جهده لتجنب تعريض الأحماض الدهنية والكوليسترول إلى الضرر التأكسدي. لكن التركيز العالي للغاية للأكسجين في الدم يجعل من الصعب للغاية حماية الدهون والكوليسترول أثناء النقل عبر الدم ، وربما يؤدي أيضًا إلى زيادة لا يمكن تجنبها في امتصاص الأكسجين وبالتالي التعرض داخل الدماغ نفسه.
14. الدهون خيار صحي!
يجب أن تكون معزولًا تمامًا مثل السكان الأصليين الأستراليين حتى لا تستوعب الرسالة القائلة بأن الدهون الغذائية ، وخاصة الدهون المشبعة ، غير صحية. أنا واثق تمامًا من أن هذه الرسالة خاطئة ، ولكن يكاد يكون من المستحيل تغيير اتجاه الرأي بسبب وجودها المنتشر. معظم الناس لا يتساءلون لماذا الدهون سيئة. إنهم يفترضون أن الباحثين يجب أن يكونوا قد قاموا بواجبهم ، وهم يثقون في النتيجة.
القول بأن الوضع الحالي فيما يتعلق بالدهون الغذائية مربك سيكون أمرًا بخسًا. يقال لنا مرارًا أن نحافظ على إجمالي استهلاكنا من الدهون إلى 20 ٪ من إجمالي السعرات الحرارية. يصعب تحقيق ذلك ، وأعتقد أنها نصيحة خاطئة. في تناقض مباشر مع هذا الهدف "قليل الدسم" ، نشجعنا على استهلاك أكبر قدر ممكن من أنواع الدهون "الجيدة". لحسن الحظ ، أصبحت الرسالة أخيراً مشهورة على نطاق واسع بأن دهون أوميغا 3 صحية وأن الدهون المتحولة غير صحية للغاية. DHA (حمض docosahexaenoic) هو دهون أوميغا 3 توجد بكميات كبيرة في الدماغ السليم. في النظام الغذائي ، يتوفر بشكل رئيسي من أسماك المياه الباردة ، ولكن البيض ومنتجات الألبان هي أيضًا مصادر جيدة. يتم توليد الدهون غير المشبعة عن طريق عملية عالية الحرارة تعمل على تحلل الدهون المتعددة غير المشبعة في تكوين أكثر استقرارًا ، مما يزيد من فترة صلاحيتها ولكنه يجعلها غير طبيعية لدرجة أنه لا يمكن تقريبًا تسميتها بالطعام. تتسبب الدهون المتحولة في إلحاق ضرر بالغ بصحة القلب والدماغ. وقد ثبت أن الاستهلاك العالي للدهون المتحولة يزيد من خطر الإصابة بمرض الزهايمر [41]. تنتشر الدهون المتحولة بشكل خاص في الأطعمة عالية المعالجة - خاصة عندما يتم تحويل الدهون إلى مسحوق.
يقال لنا أن نتجنب الدهون المشبعة ، ويرجع ذلك بشكل رئيسي إلى أنها ظهرت ، من الأدلة التجريبية ، على أنها أكثر عرضة لرفع مستويات LDL من الدهون غير المشبعة. ومع ذلك ، فإن هذه الدهون أقل عرضة للأكسدة ، وقد يكون هذا هو السبب في ظهورها في LDL - لأنها ذات جودة أعلى وبالتالي يجب أن يتم تسليمها بشكل تفضيلي إلى الأنسجة لأدوار وظيفية بدلاً من الوقود (أي الأحماض الدهنية الحرة) . أثبت زيت جوز الهند ، وهو دهون مشبعة ، أنه مفيد لمرضى الزهايمر [42]. وقد ثبت أن منتجات الألبان الغنية بالدهون (عالية الإشباع أيضًا) مفيدة للخصوبة بين النساء [10] ، وبشكل ملحوظ ، لأمراض القلب [37] [22].
على الرغم من الاعتقاد السائد بأن الدهون (خاصة الدهون المشبعة) غير صحية ، فإن مقالة ظهرت في المجلة الأمريكية للتغذية السريرية في عام 2004 [37] تدعي أنه بالنسبة لمجموعة من النساء بعد انقطاع الطمث ، فإن الدهون عالية الدهون عالية التشبع -حمية الدهون توفر حماية أفضل من مرض الشريان التاجي من نظام غذائي منخفض الدهون (25 ٪ من السعرات الحرارية من الدهون). كانت الموضوعات في الدراسة من النساء البدينات المصابات بمرض الشريان التاجي. معظمهم يعانون من ارتفاع ضغط الدم ، والكثير منهم مصابون بالسكري. تتناسب مع الملف الشخصي لمتلازمة التمثيل الغذائي التي سبق لي أن جادلتها هي نتيجة مباشرة لنظام غذائي منخفض الدهون عالي الكربوهيدرات لفترات طويلة. يسرني أن أرى أن فرضيتي أن زيادة تناول الدهون ستقلل من خطر الإصابة بأمراض القلب قد تم التحقق منها من خلال دراسة مضبوطة بعناية.
تم الانتهاء من تحقيق آخر حيث تبين أن الدهون توفر الحماية من أمراض القلب. تضمن دراسة طويلة الأمد لعدد كبير من الرجال السويديين [22]. نظر الباحثون إلى منتجات الألبان منخفضة الدسم ، وكذلك استهلاك الفواكه والخضروات ، واللحوم ، والحبوب ، وما إلى ذلك. وكانت النتيجة الوحيدة المهمة إحصائيًا التي وفرت الحماية من أمراض القلب هي مزيج من منتجات الألبان عالية الدسم والكثير من الفاكهة والخضروات. الفواكه والخضروات مع منتجات الألبان قليلة الدسم لا توفر أي حماية.
أظن أن أحد العناصر الغذائية الهامة التي توفرها الفواكه والخضروات هي مضادات الأكسدة التي تساعد على إطالة عمر الدهون. المصادر الممتازة الأخرى لمضادات الأكسدة تشمل الفواكه الملونة الغنية مثل التوت والطماطم والقهوة والشاي الأخضر والشوكولاتة الداكنة والعديد من التوابل ، خاصة القرفة والكركم (مكون رئيسي من الكاري). يجب استهلاكها بكثرة مع الدهون للحصول على أفضل النتائج.
الدهون المتعددة غير المشبعة مثل زيت الذرة وزيت الكانولا غير صحية للدماغ على وجه التحديد لأنها غير مشبعة. هناك مشكلتان رئيسيتان: (1) لديهم نقطة انصهار منخفضة ، مما يعني أنه إذا تم استخدامها للقلي سيتم تحويلها إلى دهون متحولة ، وهي غير صحية للغاية ، و (2) أكثر عرضة للإصابة زنخ (مؤكسد) في درجة حرارة الغرفة من الدهون المشبعة ، أي أن مدة صلاحيتها أقصر.
أجرى الباحثون في ألمانيا مؤخرًا تجربة بارعة تهدف إلى تحديد مدى تأثير درجة نضارة الدهون المتعددة غير المشبعة على عملية التمثيل الغذائي لتلك الدهون في الفئران المرضعة الأنثوية [43]. قاموا بتقسيم الفئران الأنثوية إلى مجموعتين ، والفرق الوحيد بين مجموعة الاختبار والضوابط هو أن مجموعة الاختبار أعطيت الدهون التي تم تركها في مكان دافئ نسبيًا لمدة 25 يومًا ، مما تسبب في أضرار تأكسدية كبيرة ، في حين كانت عناصر التحكم إطعام الدهون الطازجة بدلا من ذلك. بدأ النظام الغذائي غير المعتاد للفئران في اليوم الذي أنجبت فيه قمامة. قام الباحثون بفحص الغدد الثديية والحليب الذي أنتجته المجموعتان لمعرفة الاختلافات الواضحة. ووجد الباحثون أن حليب مجموعة الاختبار انخفض بشكل ملحوظ في كمية الدهون التي تحتويها ، وبالتالي فإن الغدد الثديية الخاصة بهم تستهلك كمية أقل من الدهون من إمدادات الدم. يمكن للمرء أن يظن أن آليات التمثيل الغذائي للفئران كانت قادرة على الكشف عن الضرر التأكسدي للدهون ، وبالتالي رفضها ، مفضلين الاستغناء عن عواقب إطعام الجراء الدهون المؤكسدة بدلاً من المخاطرة بها. ونتيجة لذلك ، اكتسبت جرو مجموعة الاختبار وزناً أقل بكثير من جرو المجموعة الضابطة.
العناصر المعبأة مثل ملفات تعريف الارتباط والبسكويت التي تحتوي على الدهون المصنعة غير المشبعة تمت معالجتها بمضادات الأكسدة وحتى المضادات الحيوية لحمايتها من التلف. بمجرد أن يتم استهلاكها ، لا يزال يتعين حمايتها من التعرض للسخرية. تعمل قوانين الكيمياء الحيوية بنفس الطريقة سواء داخل الجسم أو خارجه. هناك الكثير من البكتيريا في جميع أنحاء الجسم التي تكون حريصة على تناول التدبير المنزلي في الدهون الفاسدة. ابتكر الجسم جميع أنواع الاستراتيجيات لحماية الدهون من الأكسدة (أن تصبح فاسدة) ومن هجوم البكتيريا. لكن مهمتها أصبحت أسهل بكثير بالنسبة للدهون المشبعة بدلاً من الدهون غير المشبعة ، والدهون الطازجة بدلاً من الدهون القديمة.
إذا توقفنا عن محاولة الحصول على أقل عدد ممكن من الدهون في النظام الغذائي ، فليس علينا أن نكون مشغولين جدًا بالحصول على الأنواع "الصحيحة" من الدهون. إذا تم تزويد الجسم بوفرة من الدهون ، فيمكنه اختيار واختيار العثور على الدهون المثالية لتناسب كل حاجة معينة ؛ يمكن فقط استخدام الدهون الزائدة أو المعيبة كوقود ، حيث ليس من المهم جدًا تحديد الدهون ، طالما يمكن تفكيكها لإطلاق الطاقة.
15. الخلاصة والاستنتاج
هذا وقت مثير لأبحاث مرض الزهايمر ، حيث يتم اكتشاف اكتشافات جديدة ومفاجئة بوتيرة سريعة ، وتتزايد الأدلة لدعم الفكرة القائلة بأن مرض الزهايمر هو مرض نقص التغذية. إنه مؤشر على مدى التقدم الذي تم إحرازه في السنوات الأخيرة لملاحظة أنه تم نشر 42 ٪ من المراجع في هذا المقال في عام 2008 أو 2009. هناك نظرية شائعة جديدة مفادها أن مرض الزهايمر قد ينمو من ضعف القدرة على استقلاب الجلوكوز في الدماغ. تم ابتكار مصطلح "داء السكري من النوع الثالث" لوصف هذا العيب ، والذي يظهر غالبًا قبل ظهور أي أعراض لمرض الزهايمر بفترة طويلة [49]. يبدو أن التحول من التمثيل الغذائي الهوائي إلى استقلاب الجلوكوز اللاهوائي في الدماغ هو نذير لمرض الزهايمر في وقت لاحق من الحياة ، لكنني أجادل بأن سبب هذا التحول هو توفير مكون أساسي (البيروفات) يمكن من خلاله تصنيع الأحماض الدهنية ، وفي نفس الوقت حمايتهم من الأكسدة التي قد تكون ضارة. أليل ApoE-4 ، الذي يرتبط بزيادة خطر الإصابة بمرض الزهايمر ، يشير بوضوح إلى عيوب في نقل الدهون والكوليسترول ، والانخفاض الملحوظ في كمية الأحماض الدهنية 6 أضعاف الموجودة في السائل النخاعي لمرضى الزهايمر [38] يتحدث بصوت عال رسالة مفادها أن نقص الدهون جزء أساسي من الصورة. إن ملاحظة أن المايلين متحللة في الفصوص الأمامية لأدمغة الأشخاص الذين يمتلكون أليل apoE-4 تؤكد بشكل إضافي النظرية القائلة بأن آلية إصلاح المايلين معيبة.
من الواضح أن الكوليسترول يلعب دورًا حيويًا في وظائف الدماغ. تم العثور على ما يصل إلى 25 ٪ من إجمالي الكوليسترول في الجسم في الدماغ ، وهو موجود بكثرة في المشابك وفي غمد المايلين. وقد ثبت أن الكولسترول في كل من هذه الأماكن يلعب دورًا أساسيًا للغاية في نقل الإشارات وفي النمو والإصلاح.
بالنظر إلى الدور الإيجابي القوي الذي يلعبه الكوليسترول ، لا يمكن الافتراض إلا أن أدوية الستاتين ستزيد من خطر الإصابة بمرض الزهايمر. ومع ذلك ، كانت صناعة الستاتين ناجحة بشكل ملحوظ حتى الآن في إخفاء هذه الحقيقة المؤلمة. لقد تمكنوا من جعل الكثير من الملاحظة أن ارتفاع الكوليسترول في وقت مبكر من الحياة يرتبط بزيادة خطر الإصابة بمرض الزهايمر بعد ثلاثين عامًا. ومع ذلك ، فإنها لا تقدم دراسة واحدة ، ولا حتى دراسة بأثر رجعي ، لإثبات أي ادعاء بأن خفض الكوليسترول بنشاط من خلال العلاج بالستاتين سيحسن الوضع بالنسبة لهؤلاء الأشخاص. في الواقع ، والأدهى من ذلك ، أن دليل استخدام الستاتين الذي يجيب على السؤال "غير متوفر" للباحثين الذين أجروا الدراسة الأساسية.
بياتريس غولومب حاصلة على درجة الدكتوراه. الذي يرأس مجموعة دراسة UCSD Statin ، وهو فريق بحثي يحقق بنشاط في توازن المخاطر والفوائد لعقاقير الستاتين. أصبحت مقتنعة بشكل متزايد أنه لا ينبغي التوصية بعقاقير الستاتين لكبار السن: أنه في حالتهم تفوق المخاطر بوضوح الفوائد. لقد قدمت حجة قوية لهذا الموقف في مقالة على الإنترنت متاحة هنا [15]. القسم الخاص بمرض الزهايمر مقنع بشكل خاص ، ويشير إلى المزالق في الاعتماد على الدراسات السابقة التي أجرتها صناعة الستاتين ، حيث غالبًا ما يتم استبعاد أولئك الذين يعانون من مشاكل في الذاكرة مثل الآثار الجانبية لعقاقير الستاتين من الدراسة ، بحيث يتم عرض النتائج في نهاية المطاف منحاز بشكل غير لائق لصالح العقاقير المخفضة للكوليسترول. باختصار ، كتبت: "يجب التأكيد على أن أدلة التجربة المعشاة قد فشلت ، حتى الآن ، بشكل موحد في إظهار الفوائد المعرفية من العقاقير المخفضة للكوليسترول ولم تدعم أي تأثير أو ضرر صريح وكبير للوظيفة المعرفية."
بالإضافة إلى رفض تناول العلاج بالعقاقير المخفضة للكوليسترول ، هناك طريقة أخرى يمكن للفرد من خلالها تحسين احتمالات الإصابة به ضد مرض الزهايمر وهي استهلاك الكثير من الدهون الغذائية. يبدو من الغريب التحول فجأة من نظام غذائي "صحي" قليل الدسم إلى نظام غذائي عالي الكيتون عالي الدهون بمجرد تشخيص مرض الزهايمر. يتكون النظام الغذائي الكيتوني ، بشكل مثالي ، من 88٪ دهون و 10٪ بروتين و 2٪ كربوهيدرات [11]. هذا يعني أنه يحتوي على نسبة عالية من الدهون. يبدو من المنطقي أكثر أن تستهدف شيئًا مثل 50٪ دهون و 30٪ بروتين و 20٪ كربوهيدرات ، وذلك للدفاع بشكل استباقي ضد مرض الزهايمر.
أوصي بشدة كتابًا حديثًا كتبه جراح دماغ الأطفال ، Larry McCleary ، MD ، يسمى The Brain Trust Program [33]. يقدم هذا الكتاب ثروة من المعلومات الرائعة حول الدماغ ، بالإضافة إلى توصيات محددة حول طرق تحسين الوظيفة الإدراكية وتجنب مرض الزهايمر لاحقًا. والأهم من ذلك أنه يوصي باتباع نظام غذائي غني بالكوليسترول والدهون الحيوانية ، بما في ذلك وفرة من الأسماك والمأكولات البحرية واللحوم والبيض. كما يوصي بجوز الهند واللوز والأفوكادو والجبن ، وجميع الأطعمة التي تحتوي على كمية كبيرة من الدهون ، بينما يشجع على تجنب "الكربوهيدرات الفارغة". نمت معرفته حول هذا الموضوع من اهتمامه بمساعدة مرضاه الصغار على الشفاء بسرعة أكبر بعد صدمة الدماغ.
"لما يقرب من 20 عامًا ، تركز التركيز الأساسي للباحثين الذين يدرسون مرض الزهايمر على الأميلويد بيتا ، بحيث أصبحت فرضية سلسلة الأميلويد" الفرضية الصفرية ". في الواقع ، الأميلويد بيتا ، من خلال التعريف الحالي للمرض ، وهو لاعب ملزم في الفيزيولوجيا المرضية ، سام للخلايا العصبية في المختبر ، وربما الأكثر إلحاحًا يزداد بسبب جميع التأثيرات الوراثية البشرية على المرض. وبالتالي ، فإن استهداف بيتا النشواني هو التركيز على اهتمام أساسي وعلاجي كبير. ، تصل مجموعة متزايدة من المحققين إلى "فرضية بديلة" تنص على أن النشواني بيتا ، على الرغم من مشاركته بالتأكيد في المرض ، ليس حدثًا مبدئيًا ولكنه بالأحرى ثانوي لأحداث ممرضة أخرى. تقترح الفرضية البديلة أن دور أميلويد-بيتا ليس نذيراً للموت بل استجابة وقائية للإهانة العصبية. لتحديد أي فرضية يتعلق بشكل أفضل بمرض الزهايمر ويتطلب رؤية أوسع لمرض المرض ويتم مناقشته هنا. "
المراجع
[1] H. Akiyama، S. Barger، S. Barnum، B. Bradt، J.Bauer، G.M. كول ، ن.ر. Cooper، P. Eikelenboom، M. Emmerling، B.L. Fiebich ، C.E. Finch ، S. Frautschy ، W.S. Griffin، H. Hampel، M. Hull، G. Landreth، L. Lue، R. Mrak، I.R. ماكنزي ، P.L. ماكجير ، عضو الكنيست O'Banion، J. Pachter، G. Pasinetti، C. Plata-Salaman، J. Rogers، R.Rydel، Y. Shen، W. Streit، R. Strohmeyer، I. Tooyoma، F.L. فان Muiswinkel ، R. Veerhuis ، D. Walker ، S. Webster ، B. Wegrzyniak ، G. Wenk ، T. Wyss-Coray ، "الالتهاب ومرض الزهايمر." شيخوخة نيوروبيول (2000) مايو-يونيو ؛ 21 (3): 383-421 ،
[2] جمعية مرض الزهايمر ، "حقائق وأرقام مرض الزهايمر" ، مرض الزهايمر والخرف (2009) المجلد. 5 ، العدد 3.
[3] ك. Anstey ، DM Lipnicki and LF Low ، "الكوليسترول كعامل خطر للخرف والتدهور المعرفي: مراجعة منهجية للدراسات المستقبلية مع التحليل التلوي." Am J Geriatr الطب النفسي (2008) مايو ، المجلد. 16 ، رقم 5 ، ص 343-54.
[4] G. Arendash، A. Cox، T. Mori، J. Cracchiolo، K. Hensley، J. Roberts 2، "علاج الأكسجين يؤدي إلى ضعف إدراكي في الفئران المعدلة وراثيا لمرض الزهايمر" Neuroreport. (2009) 18 يونيو.
[5] بي جي بالين ، سي إس ليتل ، سي جي هاموند ، د. Appelt، J.A. Whittum-Hudson، H.C. جيرارد ، أ.ب.هودسون ، "الالتهاب الرئوي Chlamydophila ومسببات مرض الزهايمر المتأخر." J. Alz. ديس. (2008) المجلد. 13 ، ص 371-380.
[6] ج. بارتزوكيس ، دكتوراه في الطب ؛ P.H. Lu ، Psy ، DH Geschwind ، MD ، N.Edwards ، MA ، J. Mintz ، PhD ، and JL Cummings ، MD ، "Apolipoprotein E Genotype and Myelin انهيار في الأفراد الأصحاء: الآثار المترتبة على التدهور المعرفي والخرف ،" القوس الطب النفسي العام (2006) المجلد. 63 ، ص 63-72.
[7] N. Bernoud، L. Fenart، C. Bà © nistant، JF Pageaux، MP Dehouck، P. Molière، M. Lagarde، R.Cecchelli، d، J. Lecerf، "Astrocytes مسؤولة بشكل رئيسي عن تخصيب الأحماض الدهنية المتعددة غير المشبعة في الخلايا البطانية في الحاجز الدموي الدماغي في المختبر "Journal of Lipid Research (1998) September، Vol. 39 ، ص 1816-1824.
[8] م. س. براون وج. ل. جولدشتاين ، "مسار بوساطة مستقبلات لتوازن الكولسترول" ، محاضرة نوبل ، 9 ديسمبر 1985.
[9] N. Cartier، C. Sevin، A. Benraiss، P. DeDeyn، D. Bonnin، MT Vanier، M. Philippe، V. Gieselmann and P. Aubourg، "AAV5-med mediation of Aryl Sulfatase A (hARSA) ) يمنع تخزين Sufatide والنمط الظاهري العصبي في الفئران المتغيرة اللمفاويات البيضاء (MLD) الفئران ، "العلاج الجزيئي (2005) 11 ، S166-S167 ؛ دوى: 10.1016 / j.ymthe.2005.06.431
[10] ج. شافارو ، دبليو. ويليت ، وبي جي سكريت ، نظام الخصوبة ، (2008) ماكجرو هيل.
[11] L.C. Costantini و L.J. Barr و J.L. Vogel و S.T. هندرسون ، "نقص التمثيل الغذائي كهدف علاجي في مرض الزهايمر" BMC Neurosci (2008) Vol. 9 ، ملحق. 2 ، S16. دوى: 10.1186 / 1471-2202-9-S2-S16.
[12] V. Demarin، S.S. Podobnik، D. Storga-Tomic and G. Kay، "علاج مرض الزهايمر باستقرار نيكوتيناميد أدينين ثنائي النوكليوتيد الفموي: دراسة عشوائية مزدوجة التعمية" Drugs Exp Clin Res. (2004) المجلد. 30 ، رقم 1 ، ص 27-33.
[13] R.B. DeMattos، RP Brendza، JE Heuser، M.Kierson، J.R. Cirrito، J. Fryer، P.M. سوليفان ، أ. فاجان ، إكس هان و د. هولتزمان ، "تنقية وتوصيف البروتينات الدهنية التي تفرزها الخلايا النجمية E والبروتينات الدهنية المحتوية على J من الفئران المعدلة وراثيا apoE البشرية ،" Neurochem Int. (2001) نوفمبر - ديسمبر ؛ 39 (5-6): 415-25. دوى: 10.1016 / S0197-0186 (01) 00049-3.
[14] M. Dezfulian، MA ShokrgozarA، S. Sardari، K. Parivar and G. Javadi، "Can phages يسبب مرض الزهايمر؟" فرضيات ميد (2008) نوفمبر ؛ 71 (5): 651-6.
[15] ب. Golomb ، MD ، Ph.D. ، "تأثيرات الستاتين الضارة: الآثار المترتبة على كبار السن ،" Geriatric Times (2004) May / June ، المجلد. V ، العدد 3
[16] د. دبليو. جرانت ، "هل يقلل فيتامين د من خطر الإصابة بالخرف؟" مجلة مرض الزهايمر (2009) مايو ، المجلد. 17 ،
[17] د. دوان جرافلين ، ليبيتور: لص الذاكرة ، أدوية ستاتين والحرب المضللة على الكوليسترول ، (2004) www.buybooksontheweb.com.
[18] X. Han ، "آليات محتملة تساهم في استنفاد الكبريتات في أقرب مرحلة يمكن التعرف عليها سريريًا لمرض الزهايمر: حكاية دهون بنادق الرش" J Neurochem (2007) November، Vol. 103 ، ملحق. 1. ص 171 - 179. دوى: 10.1111 / j.1471-4159.2007.04708.x.
[19] X. Han، H. Cheng، JD D.Fryer، A.M. فاجان و د. هولتزمان ، "دور رواية ل Apolipoprotein E في الجهاز العصبي المركزي: تعديل محتوى الكبريتيدات" مجلة الكيمياء البيولوجية ، 7 مارس 2003 ، المجلد. 278 ، الصفحات 8043-8051 ، DOI 10.1074 / jbc.M212340200.
[20] K. Heininger ، "فرضية موحدة لمرض الزهايمر. رابعاً: سبب وتسلسل الأحداث" Rev Neurosci. (2000) المجلد. 11 ، المواصفات رقم ، ص.213-328.
[21] س. هندرسون ، "أجسام كيتون كعلاج لمرض الزهايمر" NeuroTherapeutics ،، (2008) Jul؛ 5 (3): 470-80، doi: 10.1016 / j.nurt.2008.05.004
[22] S. Holmberg، A. Thelin and E.-L. Stiernstr Nvm ، "اختيارات الطعام وأمراض القلب التاجية: دراسة جماعية تعتمد على السكان من الرجال السويديين الريفيين مع 12 عامًا من المتابعة ،" Int. J. Environ. الدقة. الصحة العامة (2009) المجلد. 6 ، ص 2626-2638 ؛
[23] K. Honjo و R. van Reekum و N.P. Verhoeff ، "مرض الزهايمر والعدوى: هل تساهم العوامل المعدية في تطور مرض الزهايمر؟" خرف الزهايمر. (2009) يوليو؛ 5 (4): 348-60.
[24] م. Innis and R.A. داير ، "تحضير الخلايا النجمية في الدماغ لحمض docosahexaenoic من الأحماض الدهنية n-3 محدود عند استطالة حمض docosapentaenoic" (2002) September Journal of Lipid Research، Vol. 43 ، ص 1529-1536.
[25] ل. جينغ ، أ. Yamshchikov ، S.E. جود ، جلالة الملك Blumberg ، GS Martin ، T.R. Ziegler و V. Tangpricha ، "تعديلات في حالة فيتامين D ومستويات الببتيد المضادة للميكروبات لدى المرضى في وحدة العناية المركزة المصابين بإنتان الدم ،" مجلة الطب الانتقالي "، (2009) المجلد 7 ، رقم 28.
[26] J. Kountouras، M. Boziki، E. Gavalas، C. Zavos، G. Deretzi، N. Grigoriadis، M. Tsolaki، D. Chatzopoulos، P. Katsinelos، D. Tzilves، A. Zabouri، I. Michailidou ، "زيادة الأجسام المضادة لجراثيم هيليكوباكتر بيلوري في مرض الزهايمر ،" ي ي نيوروسسي. (2009) 119 (6): 765-77.
[27] J.Kountouras، M. Boziki، E. Gavalas، C. Zavos، N. Grigoriadis، G. Deretzi، D. Tzilves، P. Katsinelos، M. Tsolaki، D. Chatzopoulos، و I. Venizelos، "Eradication قد يكون مفيدًا في إدارة مرض الزهايمر ، J Neurol. (2009) مايو ؛ 256 (5): 758-67. Epub 2009 فبراير 25.
[28] H.G. Lee، X. Zhu، RJ. Castellani، A. Nunomura، G. Perry، MA MA Smith، "Amyloid-beta in the alzheimer disease: null null to the فرضية الفرضيات ،" J Pharmacol Exp Ther. (2007) حزيران / يونيو ، المجلد. 321 رقم 3 ، ص 823-9. دوى: 10.3390 / ijerph6102626.
[29] J. Marcus، S. Honigbaum، S. Shroff، K. Honke، J. Rosenbluth and J.L. Dupree، "Sulfatide ضروري للحفاظ على بنية الميالين والميلون CNS ،" Glia (2006) ، المجلد. 53 ، ص 372-381.
[30] ر. Matthews و L. Yang و S. Browne و M. Baik و M.F. بيل ، "إدارة الإنزيم المساعد Q10 يزيد من تركيزات الميتوكوندريا في الدماغ ويمارس التأثيرات العصبية ،" Proc Natl Acad Sci U S A. (1998) Jul 21، Vol. 95 ، رقم 15 ، ص 892-7.
[31] D. Lutjohann and K. von Bergmann، "24S-hydroxycholesterol: علامة على استقلاب الكوليسترول في الدماغ" علم الأدوية النفسية (2003) ، 10 يناير ، المجلد. 36 ملحق 2 ، ص S102-6 ، DOI: 10.1055 / s-2003-43053.
[32] ج. سي. ماكان وب. أميس ، "هل هناك أدلة بيولوجية أو سلوكية مقنعة تربط نقص فيتامين د بخلل في الدماغ؟" ، (2008) FASEB J. Vol. 22 ، ص 982-1001. دوى: 10.1096 / fj.07-9326rev.
[33] Larry McCleary، MD، The Brain Trust Program (2007) September، The Penguin Group، New York، New York.
[34] B. McGuinness et al.، "Statins for the Prevention of dementia،" Cochrane Database of Systematic Reviews، (2009) No. 2.
[35] م. ميلكي ، ص. Zandi، M. Sjogren، et al. "ارتفاع مستويات الكوليسترول الكلي في أواخر الحياة المرتبطة بانخفاض خطر الإصابة بالخرف ،" Neurology (2005) Vol. 64 ، ص 1689-1695.
[36] سا مور ، "تخليق الأحماض الدهنية المتعددة غير المشبعة وإطلاقها بواسطة الخلايا المشتقة من الدماغ في المختبر" ، مجلة علم الأعصاب الجزيئي (2001) ، المجلد. 16 ، ص 195 وما بعدها.
[37] D. Mozaffarian، E.B. ريم ، د. هيرينجتون ، "الدهون الغذائية ، الكربوهيدرات ، وتطور تصلب الشرايين التاجية لدى النساء بعد انقطاع الطمث" Am J Clin Nutr (2004) Vol. 80 ، ص 1175-84.
[38] م. مولدر ، ر. رافيد ، د. Swaab، E.R. de Kloet، E.D. Haasdijk ، J. Julk ، J.J. van der Boom و L.M. Havekes ، "إن انخفاض مستويات الكوليسترول والفوسفوليبيدات والأحماض الدهنية في السائل الدماغي الشوكي لمرضى مرض الزهايمر لا علاقة لها بالبروتين E4 ،" مرض الزهايمر Dis Assoc Disord. (1998) سبتمبر ، المجلد. 12 ، رقم 3 ، ص 198-203.
[39] I.L. Notkola، R. Sulkava، J. Pekkanen، T. Erkinjuntti، C. Ehnholm، P. Kivinen، J. Tuomilehto، و A. Nissinen، "Serum total cholesterol، apolipoprotein E epsilon 4 allele، and alzheimer،" Neuroepidemiology (1998 ) المجلد. 17 ، رقم 1 ، ص 14-20.
على توصيل الكوليسترول عن طريق الخلايا النجمية؟" ، BioEssays (2003) Vol. 25 العدد 1 ص 72-78.
[41] A. Phivilay ، C. Julien ، C. Tremblay ، L. Berthiaume ، P. Julien ، Y. Giguère and F. Calon ، "الاستهلاك الغذائي العالي من الأحماض الدهنية غير المشبعة يقلل من حمض docosahexaenoic في الدماغ ولكنه لا يغير اميلويد أمراض بيتا وتاو في نموذج 3xTg-AD لمرض الزهايمر. " علم الأعصاب (2009) 3 مارس ، المجلد. 159 ، رقم 1 ، ص 296-307. Epub 2008 ديسمبر 14.
[42] M. Reger، S. T. Henderson، C. Hale، B. Cholerton، L.D. بيكر ، جي إس واتسون ، ك. هايد ، د. 25 ، رقم 3 ، مارس ، ص 311-314 ،
[43] R. Ringseis، C. Dathe، A. Muschick، C. Brandsch and K. Eder، "Nutrient Physiology، Metabolism، and Nutrient-Nutrient Interactions Fat Oxides Reduces Milk Triacylglycerol Milk by تثبيط التعبير الجيني عن الليبوبروتين الدهني والأحماض الدهنية الناقلون في الغدة الثديية للجرذان ، "الجمعية الأمريكية للتغذية J. Nutr. (2007) سبتمبر ، المجلد. 137 ، ص 2056-2061.
[44] ك. روكوود ، "التجارب الوبائية والسريرية دليل على دور وقائي للستاتينات في مرض الزهايمر". Acta Neurol Scand Suppl. (2006) المجلد. 185 ، ص 71-7.
[45] G. Saher، B. Brugger، C. Lappe-Siefke، W. Mobius، R. Tozawa، MC Wehr و F. Wieland و S. Ishibashi و K.A. ناف ، "ارتفاع مستوى الكوليسترول ضروري لنمو غشاء المايلين". نات نيوروسسي (2005) أبريل ، المجلد. 8 ، رقم 4 ، ص 468-75. Epub 2005 مارس 27.
[46] أ. سولومون ، م.كيفيبيلتو ، ب. ويتمر ، "مصل الكوليسترول في منتصف العمر وزيادة خطر الإصابة بالزهايمر والخرف الوعائي بعد ثلاثة عقود" ، الخرف والاضطرابات المعرفية الشيخوخة (2009) المجلد. 28 ، ص 75-80 ، دوى: 10: 1159/000231980.
[47] M. Simons، MD، P. Keller، PhD، J. Dichgans، MD and J.B. Schulz، MD، "Cholesterol and Alzheimer disease: هل هناك صلة؟" علم الأعصاب (2001) المجلد. 57 ، ص 1089-1093.
[48] إل إل سميث ، "فرضية أخرى للكوليسترول: الكوليسترول كمضاد للأكسدة" Free Radic Biol Med. (1991) المجلد. 11 ، رقم 1 ، ص 47-61.
[49] إ. ستين ، ب. تيري ، إي. Rivera، JL Cannon، T.R. نيلي ، ر. تافاريس ، إكس. Xu و J.R. Wands و S.M. de la Monte "ضعف الأنسولين وآليات التعبير والتشبيه بعوامل النمو الشبيهة بالأنسولين في مرض الزهايمر - هل هذا هو النوع 3 من مرض السكري؟" مجلة مرض الزينر (2005) المجلد. 7 ، رقم 1 ، ص 63-80.
[50] جيه تونغ ، ص. بوربات ، ج. Freed and Y-K Shin ، "آلية مقصية لتحفيز خلط الدهون بواسطة بوساطة SNARE بواسطة الكوليسترول" ، PNAS (2009) 31 مارس. 106 ، رقم 13 ، ص 5141-5146.
[51] M-C Vohl، T. A.-M. Neville و R. Kumarathasan و S. Braschi و D.L. سباركس ، "نشاط مضاد للأكسدة Lecithin-Cholesterol Acyltransferase يمنع تكوين الدهون المؤكسدة أثناء أكسدة البروتين الدهني ،" الكيمياء الحيوية (1999) المجلد. 38 رقم 19 ، ص 5976-5981. دوى: 10.1021 / bi982258w.
[52] M. Waldman، MD ،، المؤتمر الدولي التاسع حول مرض الزهايمر ومرض باركنسون (2009) الملخص 90 ، تم تقديمه في 12-13 مارس.
[53] R. West، M.A.، M. Schnaider Beeri، Ph.D.، J. Schmeidler، Ph.D.، C. M. Hannigan، BS، G. Angelo، MS، H.T. غروسمان ، MD ، C. Rosendorff ، MD ، Ph.D. ، و JM Silverman ، Ph.D. ، "أداء ذاكرة أفضل مرتبط بمستويات أعلى من الكوليسترول الكلي ومستوى الكوليسترول الضار في الموضوعات المسنة جدًا بدون أليل APOE4 ،" Am J Geriatr Psychiatry (2008) سبتمبر ؛ المجلد 16 ، رقم 9 ، ص 781-785. دوى: 10.1097 / JGP.0b013e3181812790.
[54] A.W.E. Weverling-Rijnsburger، GJ بلاو ، أ. Lagaay ، D.L. Knook و A.E. Meinders و RGJ ويستيندورب ، "الكوليسترول الكلي وخطر الوفاة عند كبار السن" The Lancet، (1997) Vol. 350 ، رقم 9085 ، ص 1119-1123 ،
[55] ر. ويلسون وجيه إف بارليتا وجي جي Tyburski ، "نقص الكوليسترول في الدم في الإنتان والمرضى الذين يعانون من أمراض خطيرة أو المصابين" رعاية حرجة (2003) ، المجلد. 7 ، ص 413-414.
[56] S.-C. Zhang and S. Fedoroff، "Neuron-microglia Interactions in Vitro،" Acta Neuropathol (1996) Vol. 91 ، ص 385-395
APOE-4: الدليل على أن النظام الغذائي قليل الدسم والستاتين قد يسبب مرض الزهايمر بواسطة ستيفاني سينيف مرخص بموجب ترخيص Creative Commons Attribution 3.0 الولايات المتحدة.
 وإعادة توزيعها إلى جزيئات أصغر بكثير ، والتي تحتوي أيضًا على كميات كبيرة من الكوليسترول. تسمى هذه الجسيمات "البروتينات الدهنية" (من الآن فصاعدًا ، LPP's) لأنها تحتوي على بروتين في الغلاف الكروي والدهون (الدهون) في الداخل. إذا قمت بقياس الكوليسترول لديك ، فربما سمعت عن LDL (LPP منخفض الكثافة) و HDL (LPP عالي الكثافة). إذا كنت تعتقد أن هذين نوعين مختلفين من الكوليسترول ، فستكون مخطئًا. وهما نوعان مختلفان من حاويات الكوليسترول والدهون التي تؤدي أدوارًا مختلفة في الجسم. في الواقع هناك العديد من LPP الأخرى ،
وإعادة توزيعها إلى جزيئات أصغر بكثير ، والتي تحتوي أيضًا على كميات كبيرة من الكوليسترول. تسمى هذه الجسيمات "البروتينات الدهنية" (من الآن فصاعدًا ، LPP's) لأنها تحتوي على بروتين في الغلاف الكروي والدهون (الدهون) في الداخل. إذا قمت بقياس الكوليسترول لديك ، فربما سمعت عن LDL (LPP منخفض الكثافة) و HDL (LPP عالي الكثافة). إذا كنت تعتقد أن هذين نوعين مختلفين من الكوليسترول ، فستكون مخطئًا. وهما نوعان مختلفان من حاويات الكوليسترول والدهون التي تؤدي أدوارًا مختلفة في الجسم. في الواقع هناك العديد من LPP الأخرى ، موجود فقط في السائل الدماغي الشوكي ، والذي يوفر الاحتياجات الغذائية للدماغ والجهاز العصبي. لا يبدو أن هذا الاسم يحمل اسمًا بعد ، لكنني سأطلق عليه "B-HDL" ، لأنه يشبه HDL من حيث حجمه ، و "B" هو لـ "الدماغ [13]"
موجود فقط في السائل الدماغي الشوكي ، والذي يوفر الاحتياجات الغذائية للدماغ والجهاز العصبي. لا يبدو أن هذا الاسم يحمل اسمًا بعد ، لكنني سأطلق عليه "B-HDL" ، لأنه يشبه HDL من حيث حجمه ، و "B" هو لـ "الدماغ [13]" [55]. الكولسترول هو خط الدفاع الأول ضد هذه الميكروبات ، حيث أنه ينبه خلايا الدم البيضاء للهجوم كلما واجهت مسببات الأمراض الخطيرة. كما تم اقتراح أن الكوليسترول في غلاف XDL يعمل كمضاد للأكسدة [48].
[55]. الكولسترول هو خط الدفاع الأول ضد هذه الميكروبات ، حيث أنه ينبه خلايا الدم البيضاء للهجوم كلما واجهت مسببات الأمراض الخطيرة. كما تم اقتراح أن الكوليسترول في غلاف XDL يعمل كمضاد للأكسدة [48]. يتم تصنيع فيتامين د من الكوليسترول في الجلد ، عند التعرض لأشعة الشمس فوق البنفسجية. في الواقع ، لا يمكن تمييز الصيغة الكيميائية لفيتامين D تقريبًا عن تلك الخاصة بالكوليسترول ، كما هو موضح في الشكلين المرفقين (الكوليسترول على اليسار ، فيتامين د على اليمين). إذا كانت مستويات LDL
يتم تصنيع فيتامين د من الكوليسترول في الجلد ، عند التعرض لأشعة الشمس فوق البنفسجية. في الواقع ، لا يمكن تمييز الصيغة الكيميائية لفيتامين D تقريبًا عن تلك الخاصة بالكوليسترول ، كما هو موضح في الشكلين المرفقين (الكوليسترول على اليسار ، فيتامين د على اليمين). إذا كانت مستويات LDL

